题目内容
有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是( )
| A.氧化剂和还原剂的物质的量之比为1:8 |
| B.该过程说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1 mol NO3-发生氧化反应,转移8 mol 电子 |
| D.若把该反应设计为原电池,则负极反应为Fe2+- e- = Fe3+ |
C
配平此反应为:8Fe2++10H++NO3-=8Fe3++NH4++3H2O
A:由化合价升降知,还原剂为Fe2+,氧化剂为NO3-,氧化剂和还原剂的物质的量之比为1:8,正确
B:Fe(NO3)2溶液如果加酸,则引入H+,Fe2+将被氧化,正确
C: NO3-中的氮元素化合价降低,发生还原反应,不正确
D:负极失电子,正确
答案为C
A:由化合价升降知,还原剂为Fe2+,氧化剂为NO3-,氧化剂和还原剂的物质的量之比为1:8,正确
B:Fe(NO3)2溶液如果加酸,则引入H+,Fe2+将被氧化,正确
C: NO3-中的氮元素化合价降低,发生还原反应,不正确
D:负极失电子,正确
答案为C

练习册系列答案
相关题目
 铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: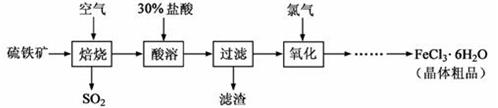
 Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ;
Fe2O3+ SO2↑;该反应中,FeS2为 剂;SO2为 产物,其常常用于制备硫酸,反应过程中的化学反应方程式为 、 ; 的拆写结果是
的拆写结果是 :氧化反应为:
:氧化反应为: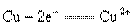 ;还原反应为:
;还原反应为: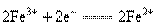 。
。 ,则还原反应的半反应可写为___________________ 。
,则还原反应的半反应可写为___________________ 。