题目内容
10.下列除去杂质的方法正确的是( )| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | Fe2O3 | SiO2 | NaOH | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 分液 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硅可与氢氧化钠溶液反应;
B.含少量CO,不易燃烧;
C.生成氯化铜,引入新杂质;
D.乙醇、水都与钠反应.
解答 解:A.氧化铁与氢氧化钠溶液不反应,二氧化硅可与氢氧化钠溶液反应,然后过滤可分离,故A正确;
B.含少量CO,不易燃烧,且易混入氧气,故B错误;
C.氯化铁与铜反应生成氯化铜和氯化亚铁,引入新杂质,故C错误;
D.乙醇、水都与钠反应,应加入生石灰,故D错误.
故选A.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
相关题目
1.下列有关实验及操作的叙述中,错误的是( )
| A. | 用水将苯、乙酸、四氯化碳区分开来 | |
| B. | 在实验室中通常将钠保存在汽油里 | |
| C. | 用稀硝酸洗去残留在试管壁上的银 | |
| D. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗涤 |
15.下表是某“加碘食盐”包装袋上的部分文字说明.
(1)经测定,该“加碘食盐”中KIO3的含量为42.8mg•kg-1.计算每千克“加碘食盐”中KIO3的物质的量为多少?该“加碘食盐”的含碘量为多少?.
(2)将5.0g该“加碘食盐”溶于水中配成100mL溶液,该溶液中IO${\;}_{3}^{-}$离子物质的量浓度为多少?
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40mg•kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
(2)将5.0g该“加碘食盐”溶于水中配成100mL溶液,该溶液中IO${\;}_{3}^{-}$离子物质的量浓度为多少?
2.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 | |
| D. | 打开啤酒瓶盖后产生大量的气泡 |
19.依据题目要求回答下列问题.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+ 能力最强的是CO32-.
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
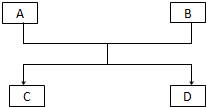 已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.
已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.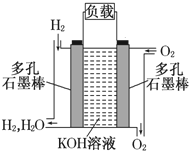 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题: