题目内容
【题目】Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图: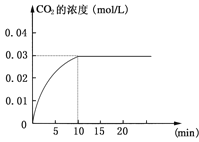
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
【答案】Ⅰ、(1)0.003;0.03;9(2)①③(3)0.01Ⅱ、4.7×10-7
【解析】
试题分析:Ⅰ、(1)v(CO2)=(0.03mol/L0)÷10min=0.003mol/(L·min),根据同一反应中同一时间段内各物质的反应速率之比等于其计量数之比得v(CO)=v(CO2)=0.003mol/(L·min);平衡时CO2的浓度是0.03mol/L,则根据方程式可知生成氢气的浓度是0.03mol/L;
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L) 0.04 0.04 0 0
反应(mol/L) 0.03 0.03 0.03 0.03
平衡(mol/L) 0.01 0.01 0.03 0.03
因此该反应化学平衡常数K=c(CO2)·c(H2)/c(CO)·c(H2O)=(0.03×0.03)/(0.01×0.01)=9;
(2)①CO减少的化学反应速率和CO2减少的化学反应速率相等表示正逆反应速率相等,反应达到平衡状态,正确;②CO、H2O、CO2、H2的浓度都相等,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,错误;③CO、H2O、CO2、H2的浓度都不再发生变化,正逆反应速率相等,该反应达到平衡状态,正确;④平衡时正、逆反应速率相等,但不为零,错误,答案选①③;
(3)设平衡时c(CO)为xmol/L,
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L) 0.02 0.02 0.02 0.02
反应(mol/L) 0.02-x 0.02-x 0.02-x 0.02-x
平衡(mol/L) x x 0.04-x 0.04-x
温度不变,化学平衡常数不变,所以化学平衡常数K=(0.04x)·(0.04x)/x·x=9,解得x=0.01;
Ⅱ、当AgCl开始沉淀时,溶液中![]()
![]() 。
。