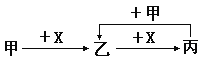题目内容
【题目】【物质结构与性质】 (15 分)
钒、砷均属于第四周期元素,最高正价均为+5。
I .高纯度砷可用于生产具有“半导体贵族”之称的新型半导体材料GaAs,砷与氯气反应可得到 AsCl3、AsCl5两种氯化物。
(1)AsCl3分子的空间构型是 ,中心原子杂化类型是 。两种氯化物分子中属于非极性分子的是 。
(2)Ga与As相比,第一电离能较小的元素是 ,GaAs中砷的化合价为 。
II.钒是一种重要的战略金属,其最主要的用途是生产特种钢,其化合价有+5、+4、+3、+2等,工业上从炼钢获得的富钒炉渣中(内含 V2O5)提取钒的过程如下。
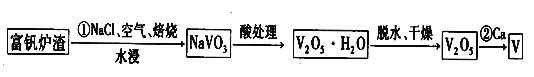
(3)基态钒原子的价电子排布式为 ,写出反应①的化学方程式: 。
(4)已知单质钒的晶胞为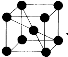 ,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
【答案】(1)三角锥形;sp3杂化;AsCl5
(2)Ga;-3
(3)3d34s2;2V2O5+4NaCl+O2![]() 4NaVO3+2Cl2
4NaVO3+2Cl2
(4)8;NAρa3/2
【解析】
试题分析:(1)AsCl3分子的价层电子对数为4,含有一对孤对电子,所以立体构型为三角锥形,其中As的杂化轨道类型为sp3。AsCl3分子属于极性分子,AsCl5分子为正六面体构型,属于非极性分子。
(2)同周期自左向右原子半径逐渐减下,则原子半径Ga大于As,由于As的4p轨道电子处于半充满状态,稳定性强,所以第一电离能较小的元素是Ga;GaAs中砷的化合价为-3价。
(3)V为23号元素,根据构造原理知基态钒原子的价电子排布式为3d34s2,根据题给流程知V2O5、NaCl在空气中焙烧生成NaVO3和氯气,化学方程式为2V2O5+4NaCl+O2 ![]() 4NaVO3+2Cl2。
4NaVO3+2Cl2。
(4)根据单质钒的晶胞结构知V 原子的配位数是8,利用切割法计算每个晶胞中含有V的数目为8×1/8+1=2,则1mol晶胞的质量为2Mg,晶胞的边长为 a cm,则1mol晶胞的体积为NAacm3 ,晶胞密度为 ρ g/cm3,则钒的相对原子质量为NAρa3/2。

【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 | 强电解质 | 弱电解质 | 非电解质 |
A | CaCO3 | H2SiO3 | 酒精 |
B | NaCl | NH3 | BaSO4 |
C | Fe | CH3COOH | 蔗糖 |
D | HNO3 | Fe(OH)3 | H2O |
A. A B. B C. C D. D