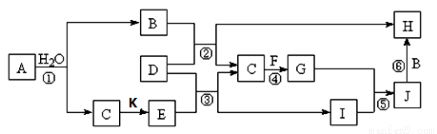
题目内容
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
(1) ③⑤(2分)
(2)c(Na+)>c(HCO3―)>c(OH―)>c(CO32―)(2分)
HCO3― + H2O H2CO3 + OH―(1分)
H2CO3 + OH―(1分)
(3)① HA是弱酸(1分);② 大于(1分);等于(1分);③ 10 -5(2分)
【解析】
试题分析:(1)CH3COOH、H2O部分电离,为弱电解质。
(2)0.1 mol·L-1NaHCO3溶液的pH大于8,说明HCO3?的水解程度大于电离程度,所以离子浓度由大到小的顺序为:c(Na+)>c(HCO3―)>c(OH―)>c(CO32―);HCO3?水解生成H2CO3,离子方程式为:HCO3― + H2O H2CO3 + OH―
H2CO3 + OH―
(3)① 等体积、等浓度的HA和NaOH恰好反应,生成NaA,溶液的pH为9,说明NaA水解显碱性,则HA为弱酸。
②因为恰好完全反应时溶液显碱性,所以溶液为中性时,HA过量,即c(HA)大于0.2mol?L?1;根据电荷守恒可得:c(H+)+c(Na+)=c(OH?)+c(A-),因为H+浓度等于OH?浓度,所以c(A-)=c(Na+)。
③水电离出的c(OH-)=10-14÷10-9mol/L= 10 -5mol/L
考点:本题考查弱电解质的判断、离子浓度比较、方程式的书写、离子浓度的计算。