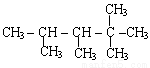题目内容
某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
D
【解析】
试题分析:A.甲酸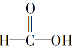 分子中也含有醛基,所以无论是否含有甲醛,都会有该现象。错误。B.甲酸与加入过量的氢氧化钠充分反应后的得到的甲酸钠中仍然含有醛基,所以溶液一样可以能发生银镜反应,不能证明是否含有甲醛。错误。C.酸与醇发生酯化发生的实质是酸脱羟基醇脱氢。所以将甲酸溶液进行酯化反应后的混合液含有甲酸及甲酸酯中都含有醛基,可以发生银镜反应。因此不能证明含有甲醛。错误。D.向甲酸溶液中加入足量氢氧化钠,发生酸碱中和反应得到甲酸钠。甲酸钠是盐,沸点高。若其中含有甲醛,则由于甲醛是分子晶体,沸点较低。加热蒸馏出的气体通入新制的氢氧化铜悬浊液加热煮沸,若有砖红色沉淀,则证明蒸馏出的气体中含有甲醛。正确。
分子中也含有醛基,所以无论是否含有甲醛,都会有该现象。错误。B.甲酸与加入过量的氢氧化钠充分反应后的得到的甲酸钠中仍然含有醛基,所以溶液一样可以能发生银镜反应,不能证明是否含有甲醛。错误。C.酸与醇发生酯化发生的实质是酸脱羟基醇脱氢。所以将甲酸溶液进行酯化反应后的混合液含有甲酸及甲酸酯中都含有醛基,可以发生银镜反应。因此不能证明含有甲醛。错误。D.向甲酸溶液中加入足量氢氧化钠,发生酸碱中和反应得到甲酸钠。甲酸钠是盐,沸点高。若其中含有甲醛,则由于甲醛是分子晶体,沸点较低。加热蒸馏出的气体通入新制的氢氧化铜悬浊液加热煮沸,若有砖红色沉淀,则证明蒸馏出的气体中含有甲醛。正确。
考点:考查甲酸中是否含有甲醛的检验方法的知识。

(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。