题目内容
【题目】化学反应速率、限度及能量与生产、生活密切相关。
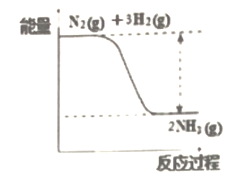
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2![]() 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率___。(设溶液体积不变)
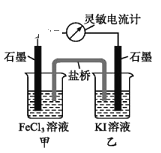
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子构成的原电池中负极反应式为___;溶液中H+移向___极(填“正“或“负")。
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
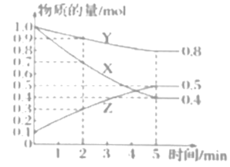
①写出该反应的化学方程式___。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___。
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为___。
【答案】小于 0.075mol·L-1·min-1 Zn-2e-=Zn2+ 正 3X+Y![]() 2Z BD 60%
2Z BD 60%
【解析】
根据图像判断反应放热还是吸热,进而判断断键吸收的能量和成键放出的能量大小关系,根据公式![]() 计算化学反应速率,根据原电池原理书写电极反应式并判断离子移向,结合图示信息得出反应物、生成物,并由化学计量数之比等于转化的物质的量书写化学方程式,判断条件是否为变量从而判断反应是否达到平衡。
计算化学反应速率,根据原电池原理书写电极反应式并判断离子移向,结合图示信息得出反应物、生成物,并由化学计量数之比等于转化的物质的量书写化学方程式,判断条件是否为变量从而判断反应是否达到平衡。
(1)由合成氨反应中的能量变化图可知,该反应为放热反应,则反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量;
(2)①锌与盐酸反应的化学方程式为Zn+2HCl=ZnCl2+H2↑,由表格数据可知2~4分钟时间段内氢气的变化量为526mL-190mL=336mL=0.336L,则![]() ,所以
,所以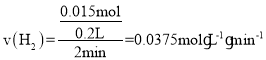 ,根据化学反应速率之比等于化学计量数之比可得
,根据化学反应速率之比等于化学计量数之比可得![]() ;
;
②在盐酸溶液中滴入少量的CuSO4溶液,可形成铜锌原电池,其中锌作负极失去电子,电极反应式为Zn-2e-=Zn2+,原电池中阳离子向正极移动,即溶液中H+向正极移动;
(3)①根据图像可知,X、Y为反应物,Z为生成物,且转化的物质的量之比为3:1:2,则该反应的化学方程式为3X+Y![]() 2Z;
2Z;
②A. 在5min时,该反应达到了平衡状态,此时X、Y、Z的浓度不相等,因此X、Y、Z浓度相等,不能说明反应达到平衡,A不选;
B.该反应为前后气体体积变化的反应,压强不变时,可以说明反应达到平衡,B选;
C.无论是否达到平衡,化学反应速率之比始终等于化学计量数之比,所以X、Y的反应速率比为3:1不能说明反应达到平衡,C不选;
D.生成1molY的同时生成2molZ,正逆反应速率相等,可以说明反应达到平衡,D选;
故答案选BD;
③由图像可知,5min达到平衡时X转化了0.6mol,则X的转化率=![]() 。
。