题目内容
【题目】已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如图(图中部分反应物或产物已省略):
请填空:
(1)B的电子式为;I分子的空间构型为 .
(2)反应②的实验现象为 .
(3)操作a必须在HCl气流中加热得无水物,其原因是;操作b为 .
(4)反应①的离子反应方程式为;反应③的化学反应方程式为 .
(5)已知C的燃烧热为286 kJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 .
【答案】
(1)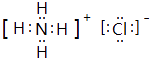 ;直线形
;直线形
(2)燃烧,发光发热,有黑色与白色固体物质生成
(3)抑制Mg2+的水解;熔融状态下电解
(4)Mg+2NH4+═Mg2++H2↑+2NH3↑;4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(5)![]() H2(g)+
H2(g)+ ![]() O2(g)=
O2(g)= ![]() H2O(g)△H=﹣143kJ/mol
H2O(g)△H=﹣143kJ/mol
【解析】解:E对空气的相对密度为0.586,其相对分子质量=0.586×29=17,且E为气体,可推知E为NH3 , E与F连续反应得到K,且F、J、K均为气体,可推知F为O2、J为NO、K为NO2 , 常温常压下G为液体,与K反应得到L浓溶液,则G为H2O、L为HNO3 , D系列转化得到黄绿色气体为Cl2 , 结合转化关系及元素守恒可推知B为NH4Cl,气体C与F反应得到G,可推知C为H2 , 非金属单质H与浓硝酸反应得到G、I、K,且金属A可以在I中燃烧得到H,可推知H为碳、I为CO2 , A为Mg,结合转化关系可知D为MgCl2 , (1)由上述分析可知,B的化学式为NH4Cl,电子式为  ,I为CO2 , 为直线形结构,所以答案是:
,I为CO2 , 为直线形结构,所以答案是:  ;直线形;(2)反应②为:反应方程式为:2Mg+CO2
;直线形;(2)反应②为:反应方程式为:2Mg+CO2 ![]() 2MgO+C,现象为:燃烧,发光发热,有黑色与白色固体物质生成,所以答案是:燃烧,发光发热,有黑色与白色固体物质生成;(3)操作a是由氯化镁溶液得到氯化镁晶体,由于溶液中镁离子水解得到氢氧化镁与HCl,必须在HCl气流中加热得无水物,而不能直接加热浓缩,其原因是抑制Mg2+的水解;操作b是电解熔融的氯化镁得到Mg与氯气,所以答案是:抑制Mg2+的水解;熔融状态下电解;(4)反应①的离子反应方程式为为:Mg+2NH4+═Mg2++H2↑+2NH3↑,反应③的化学反应方程式为:4NH3+5O2
2MgO+C,现象为:燃烧,发光发热,有黑色与白色固体物质生成,所以答案是:燃烧,发光发热,有黑色与白色固体物质生成;(3)操作a是由氯化镁溶液得到氯化镁晶体,由于溶液中镁离子水解得到氢氧化镁与HCl,必须在HCl气流中加热得无水物,而不能直接加热浓缩,其原因是抑制Mg2+的水解;操作b是电解熔融的氯化镁得到Mg与氯气,所以答案是:抑制Mg2+的水解;熔融状态下电解;(4)反应①的离子反应方程式为为:Mg+2NH4+═Mg2++H2↑+2NH3↑,反应③的化学反应方程式为:4NH3+5O2 ![]() 4NO+6H2O,所以答案是:Mg+2NH4+═Mg2++H2↑+2NH3↑;4NH3+5O2
4NO+6H2O,所以答案是:Mg+2NH4+═Mg2++H2↑+2NH3↑;4NH3+5O2 ![]() 4NO+6H2O;(5)已知氢气的燃烧热为286 kJ/mol,1g 氢气为0.5mol在氧气中完全燃烧生成液体水,放出的热量为134kJ,热化学反应方程式:
4NO+6H2O;(5)已知氢气的燃烧热为286 kJ/mol,1g 氢气为0.5mol在氧气中完全燃烧生成液体水,放出的热量为134kJ,热化学反应方程式: ![]() H2(g)+
H2(g)+ ![]() O2(g)=
O2(g)= ![]() H2O(g)△H=﹣143kJ/mol,所以答案是:
H2O(g)△H=﹣143kJ/mol,所以答案是: ![]() H2(g)+
H2(g)+ ![]() O2(g)=
O2(g)= ![]() H2O(g)△H=﹣143kJ/mol.
H2O(g)△H=﹣143kJ/mol.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案



