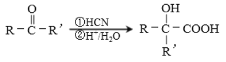
题目内容
【题目】下列各项中指定的比值是2∶1的是 ( )
A. C2H4在氧气中充分燃烧生成的CO2与H2O的物质的量之比
B. K2S溶液中c(K+)与c(S2-)之比
C. Na2O2晶体中阳离子与阴离子的物质的量之比
D. CsCl晶体中阴、阳离子的配位数比
【答案】C
【解析】
A、根据完全燃烧方程式进行判断;
B、硫离子在溶液中发生水解;
C、过氧化钠由钠离子与过氧根离子构成;
D、CsCl是由离子构成的晶体,阳离子与阴离子配位数之比为1:1。
A、C2H4在氧气中充分燃烧的方程式为:C2H4+3O2![]() 2CO2+2H2O,生成的CO2与H2O的物质的量之比为1:1,选项A不符合题意;
2CO2+2H2O,生成的CO2与H2O的物质的量之比为1:1,选项A不符合题意;
B、K2S溶液中S2-发生水解,c(K+)与c(S2-)之比大于2:1,选项B不符合题意;
C、过氧化钠由钠离子与过氧根离子构成,钠离子与过氧根离子数目之比为2:1,选项C符合题意;
D、CsCl是由离子构成的晶体,阳离子与阴离子配位数之比为1:1,选项D不符合题意;
答案选C。

 导学全程练创优训练系列答案
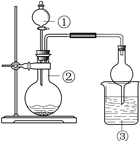
导学全程练创优训练系列答案【题目】只用如图所示装置进行下列实验,能够得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si | |
B | 饱和食盐水 | 电石 | 高锰酸钾溶液 | 生成乙炔 | |
C | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
D | 浓硫酸 | Na2SO3 | 溴水 | SO2具有还原性 |
A.AB.BC.CD.D
【题目】如图中A、B、C、D是同周期或同主族的相邻元素:
D | ||
A | B | C |
(1)已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子的质量数为_____。
(2)写出元素符号:A_____,C_____,D____。
(3)A、B、C三种元素最高价氧化物的水化物中酸性最强的是____(填化学式)。
(4)B、D两种元素和氢组成的气态氢化物中稳定性最强的是___,还原性最强的____(填化学式)。
【题目】(1)一定条件下,CO2与1.0mol·L-1NaOH溶液充分反应放出的热量如下表:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | X |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式为_____________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
温度 t/min | 0 | 40 | 80 | 120 | 160 |
甲(673K) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙(673K) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
②该反应的△H__________(填序号)
a.大于0 b.小于0 c.等于0 d.不能确定
③丙容器达到平衡时,NO的转化率为__________________。
(3)298K时,NH3·H2O的电离常数Kb=2×10-5,H2CO3的电离常数Kal=4×10-7,Ka2=4×10-11。在NH4HCO3溶液中,c(NH4+)__________c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。