题目内容
4.有Na2CO3和NaHCO3混合粉末14.8克,投入到足量稀盐酸中,产生气体3.36升(标准状况时),求Na2CO3的质量百分含量.(精确到0.1)分析 设出碳酸钠、碳酸氢钠的物质的量,分别根据生成二氧化碳的量、总质量列式计算出碳酸钠的物质的量,再根据m=nM计算出碳酸钠得到质量,最后计算出碳酸钠的百分含量.
解答 解:混合物中Na2CO3和NaHCO3的物质的量分别为x、y,
标准状况下3.36L二氧化碳的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,
根据C原子守恒可得:①x+y=0.15mol,
根据混合物质量可得:②106x+84y=14.8g,
联立①②解得:x=0.1mol、y=0.05mol,
则混合物中碳酸钠的质量为:106g/mol×0.1mol=10.6g,
所以混合物中碳酸钠的质量分数为:$\frac{10.6g}{14.8g}$×100%=71.6%,
答:原混合物中Na2CO3的质量百分含量为71.6%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
19.将Na2O2、Al2O3两种物质同时置于水中,待固体溶解后,向所得溶液中通入一定量HCl气体,所得溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
| A. | 3:2:1 | B. | 2:4:1 | C. | 2:3:1 | D. | 4:2:1 |
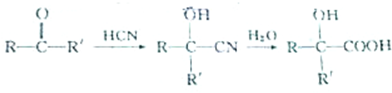 产物分子比原化合物分子多出一个碳原子,增长了碳链.
产物分子比原化合物分子多出一个碳原子,增长了碳链.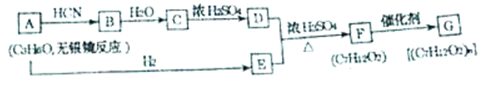
 .
.
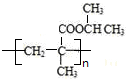
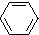 ,Y
,Y .
.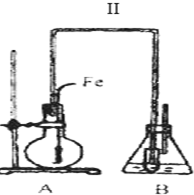 色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.
色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.