题目内容
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:
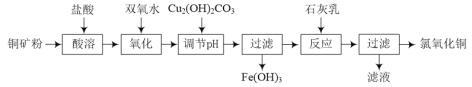
⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
【答案】4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑ [4,5] 当加入最后一滴AgNO3溶液时,出现砖红色沉淀 3CuO·CuCl2·4H2O
【解析】
铜矿粉溶于盐酸溶液中,含有Cu2+、Fe2+、Fe3+,加双氧水将Fe2+氧化成Fe3+,此时溶液中存在着Fe3+的水解平衡,加入碱式碳酸铜调节pH值,使Fe3+转化成沉淀除去。加入石灰乳将Cu2+沉淀: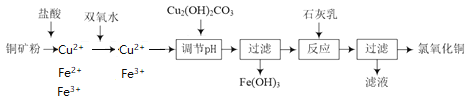
(1)Fe3+水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+浓度减小使平衡正向移动, Fe3+转化成氢氧化铁沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,将俩方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+浓度减小使平衡正向移动, Fe3+转化成氢氧化铁沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,将俩方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
(2)使溶液中的Fe3+完全变成沉淀时的pH计算:Ksp[Fe(OH)3]=1×10-36=c(Fe3+)×c3(OH—),c(Fe3+)=1×10-6molL—1,解得c(OH—)=1×10—10molL—1,pH=4;使常温溶液中c(Cu2+)≥0.022mol·L-1 pH计算:Ksp[Cu (OH)2]=2.2×10—20=c(Cu2+)×c2(OH—),c(Cu2+)=0.022molL—1,解得c(OH—)=1×10—9molL—1,pH=5;故pH 范围:[4,5]。
(3)①当氯离子已沉淀完全,多加入一滴AgNO3溶液时,CrO42—开始沉淀出现砖红色。
②n(Cl—)=n(AgNO3)=0.1000 mol·L-1×0.02 L=0.002 mol,由方程式知:Cu2+ ~ Na2S2O3,n(Cu2+ ) = n(Na2S2O3)= 0.2000 mol·L-1×0.02 L=0.004 mol,结合氯氧化铜化学式[xCuO·yCuCl2·zH2O]得:n(CuO)= 0.003 mol,n(CuCl2)= 0.001 mol,
n(H2O)=![]() = 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化铜的化学式:3CuO·CuCl2·4H2O
= 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化铜的化学式:3CuO·CuCl2·4H2O