题目内容
18.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行实验如表所示:| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其变化,测其密度是相同条件下H2的45倍 | (1)A的相对分子质量为90 |
| (2)将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为C3H6O3 |
| (3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况) | (3)用结构简式表示A中含有的官能团羧基、羟基 |
(4)A的核磁共振氢谱如图: | (4)综上所述,A的结构简式为 |
(5)已知两分子A在一定条件下可生成六元环状酯,写出该反应的化学方程式:2 $→_{△}^{浓硫酸}$ $→_{△}^{浓硫酸}$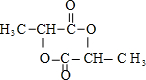 +2H2O. +2H2O. | |
分析 (1)相同条件下,气体的相对分子质量之比等于密度之比;
(2)浓硫酸可以吸收水,碱石灰可以吸收二氧化碳,根据元素守恒来确定有机物的分子式;
(3)羧基可以和碳酸氢钠发生化学反应生成二氧化碳,-OH、-COOH和金属钠发生化学反应生成氢气,根据生成气体物质的量判断含有的官能团;
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比,结合A的分子式、含有的官能团确定A的结构简式;
(5)根据A的结构简式书写.
解答 解:(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,
故答案为:90;
(2)9.0gA的物质的量=$\frac{9g}{90g/mol}$=0.1mol,浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,所以n(C)=0.3mol,n(A):n(C):n(H)=0.1mol:0.3mol:0.6mol=1:3:6,则有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数=$\frac{90-12×3-6}{16}$=3,即分子式为:C3H6O3,
故答案为:C3H6O3;
(3)9.0gA的物质的量为0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以含有一个羧基;
醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),
n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,
故答案为:羧基、羟基;
(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,所以结构简式为: ,
,
故答案为: ;
;
(5) 在一定条件下反应生成含六元环化合物的化学方程式为:2
在一定条件下反应生成含六元环化合物的化学方程式为:2 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$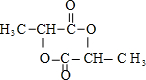 +2H2O,
+2H2O,
故答案为:2 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$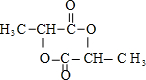 +2H2O.
+2H2O.
点评 本题是一道关于有机物的结构和性质知识的综合推断题,考查学生对知识的整合能力,难度中等,注意根据A和碳酸氢钠、钠反应时生成气体体积判断含有的官能团.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | (a-0.5)mol | B. | (a+0.5)mol | C. | (1+0.5a)mol | D. | (1-0.5a)mol |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 讲盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| B | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向饱和Na2CO3溶液中通入足量的CO2 | 溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| D | 向氯水中滴加紫色石蕊试剂 | 溶液变红 | 氯水显酸性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 实验室点燃H2前,应先检验气体纯度 | |
| C. | 氯水与亚硫酸钠溶液的混合液,漂白性更强 | |
| D. | 不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,然后涂上烧碱溶液 |
| A. | a:b=1:1 | |
| B. | Y为OH- | |
| C. | 氧化性为:SeO2>H2SO4(浓) | |
| D. | 若每生成0.2molX则该反应转移0.4NA个电子 |
| A. | CH3COONa | B. | Ba(OH)2 | C. | H2SO4 | D. | KNO3 |
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- I- |
Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+.
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O.
(3)甲同学最终确定原溶液中所含阳离子有Mg2+、Al3+,阴离子有Cl-、I-、NO3-、SO42-;并据此推测原溶液应该呈酸性,原因是Mg2++2H2O?Mg(OH)2+2H+、Al3++3H2O?Al(OH)3+3H+(请用离子方程式说明).
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L.向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为3:2.
| A. | 分子数目一定相等 | B. | 体积一定相等 | ||
| C. | 质量不一定相等 | D. | 分子中的原子数目可能相等 |
| A. | 常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,则x+y=46 | |
| B. | 1mol氯气参加氧化还原反应,一定得到2NA个电子 | |
| C. | 1L 0.1mol•L-1NaBr溶液中,HBr和Br-总和为0.1NA个 | |
| D. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为NA |