题目内容
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+ 2CO(g) N2(g) + 2CO2(g) ΔH1。
(1)已知:反应②N2(g)+O2(g) 2NO(g) ΔH2= +180.5 kJ·mol-1,CO的燃烧热为283.0 kJ·mol-1,则ΔH1=____。
(2)在密闭容器中充入5molCO和4molNO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。
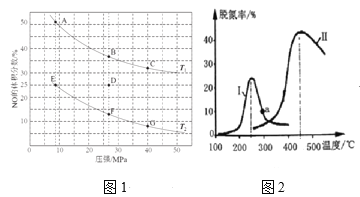
①温度:T1____T2(填“<”或“>”) 。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。若低于200℃,图2中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为______;a点_____(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由______。
II.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g) (快反应)
第二步I(g)+N2O(g) → N2(g)+IO(g) (慢反应)
第三步IO(g)+N2O(g) → N2(g)+O2(g)+I2(g) (快反应)
实验表明,含碘时N2O分解速率方程v = k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是____。
A.I2浓度与N2O分解速无关 B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的中间产物
【答案】-746.5kJ/mol > A 温度较低时,催化剂的活性偏低 不是 该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高 BD
【解析】
(1)CO燃烧热的△H1=-283.0kJmol-l,热化学方程式为:①CO(g)+![]() O2(g)=CO2(g) △H1=-283.0kJmol-l,再根据盖斯定律分析计算;
O2(g)=CO2(g) △H1=-283.0kJmol-l,再根据盖斯定律分析计算;
(2)根据(1)的计算结果,结合温度和压强对平衡的影响分析判断;
(3)催化剂在低温下活性不大;根据图像可知a点不是对应温度下的平衡脱氮率;
(4)根据反应历程结合速率方程分析判断。
(1)CO燃烧热的△H1=-283.0kJmol-l,热化学方程式为:①CO(g)+![]() O2(g)=CO2(g) △H1=-283.0kJmol-l,②N2(g)+O2(g)2NO(g)△H2=+180.5kJmol-1,根据盖斯定律,将①×2-②得:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-746.5kJ/mol,故答案为:-746.5kJ/mol;
O2(g)=CO2(g) △H1=-283.0kJmol-l,②N2(g)+O2(g)2NO(g)△H2=+180.5kJmol-1,根据盖斯定律,将①×2-②得:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-746.5kJ/mol,故答案为:-746.5kJ/mol;
(2)①根据反应2CO(g)+2NO(g)N2(g)+2CO2(g)△H=-746.5kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2,故答案为:>;
②若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点,故答案为:A。
(3)根据图像可知,温度较低时,催化剂的活性偏低,因此温度低于200℃,曲线Ⅰ脱氮率随温度升高变化不大;a点不是对应温度下的平衡脱氮率,因为该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高,故答案为:温度较低时,催化剂的活性偏低;不是;该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高;
(4)A.N2O分解反应中,实验表明,含碘时N2O分解速率方程v=kc(N2O)[c(I2)]0.5(k为速率常数),和碘蒸气有关,故A错误;B.第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应),在整个反应过程中起到决定性作用,故B正确;C.第二步反应慢说明活化能比第三步大,故C错误;D.第一步I2(g)2I(g)(快反应),第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应),第三步IO(g)+N2O(g)→N2(g)+O2(g)+H(g)(快反应),过程中IO为反应的中间产物,故D正确;故答案为:BD。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为__________(填字母序号)。


![]()



(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B中发生反应的离子方程式____________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快” __________(选填“能”或“不能”);简述你的理由:_______________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有(___________)(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
①所用指示剂为__________;滴定终点时的现象为____________________________________;
②H2C2O4溶液物质的量浓度为__________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数




