题目内容
【题目】按要求填空:
I.(1)AlCl3的水溶液pH______7(填>、=、<=,其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是_____________________(填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至_____________。
(3)物质的量浓度相同的三种溶液:①NH4Cl ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______________。(用序号表示)
(4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为____________________。
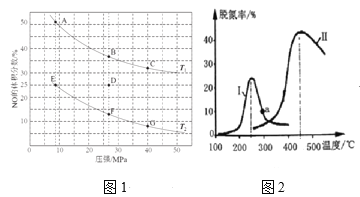
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是___________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为___mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
【答案】< Al3++3H2O![]() Al(OH)3+3H+ Al2O3 5 ③>①>② 106:1 c 酚酞 c点以上 A D 0.1050
Al(OH)3+3H+ Al2O3 5 ③>①>② 106:1 c 酚酞 c点以上 A D 0.1050
【解析】
(1)为强酸弱碱盐,水解呈酸性,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,灼烧生成氧化铝;
(2)根据Ksp= c(Cr3+)![]() c3(OH-)计算;
c3(OH-)计算;
(3)水解和电离程度都很小,依据其它离子对铵根离子水解是否有影响分析;
(4)NH4Cl溶液中H+全部来自水的电离,pH=4时,c(H+)水=c(H+)=10-4mol/L,盐酸中,HCl电离出H+,抑制水的电离,盐酸中的c(H+)水与溶液中的c(OH-)相等,c(H+)水= c(OH-)=![]() =10-10mol/L;
=10-10mol/L;
II.(1)a点是HA溶液,b点是HA和少量NaA的混合溶液,c点是NaA和少量HA的混合溶液,d点是NaA和NaOH的混合溶液,酸、碱均能抑制水的电离,NaA水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。滴定终点应在c点以上。
(2)根据c(待测)=![]() 分析;
分析;
(3)根据数据的有效性舍去第3组数据,则1、2组平均消耗V(NaOH)=![]() =21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L。
=21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L。
I.(1)氯化铝水解生成氢氧化铝和盐酸,溶液呈酸性,常温时pH<7。实验室配制氯化铝溶液时,为抑制氯化铝水解,将氯化铝溶于盐酸,然后加水稀释到所需浓度。将氯化铝溶液加热蒸干,促进氯化铝水解,平衡向右移动,盐酸挥发,得到氢氧化铝固体,灼烧得到氧化铝,
故答案为:<;Al3++3H2O![]() Al(OH)3+3H+ ;Al2O3;
Al(OH)3+3H+ ;Al2O3;
(2)当c(Cr3+)=10-5mol/L时,Ksp= c(Cr3+)![]() c3(OH-),溶液的c(OH-)=
c3(OH-),溶液的c(OH-)=![]() =10-9 mol/L,c(H+)═
=10-9 mol/L,c(H+)═![]() =10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5;
(3)NH4Cl溶液中,氯离子不影响铵根离子的水解,氨水中一水合氨电离程度很小,硫酸氢铵中,氢离子对铵根离子的水解起到抑制作用,所以三种溶液中,铵根离子的浓度大小顺序是:③>①>②,
故答案为:③>①>②;
(4)①中由水电离出的c(H+)=10-4mol/L,②中由水电离出的c(H+)=10-10mol/L,二者比值为10-4mol/L:10-10mol/L=106:1,
故答案为:106:1;
II.(1)a点是HA溶液,b点是HA和少量NaA的混合溶液,c点是NaA和少量HA的混合溶液,d点是NaA和NaOH的混合溶液,酸、碱均能抑制水的电离,NaA水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。滴定终点应在c点以上。
故答案为:c ;酚酞;c点以上;
(2)A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() ,可以知道测定c(HA)偏大,故A正确;
,可以知道测定c(HA)偏大,故A正确;
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定,被滴定的HA溶质的量不变,对结果没有影响,故B错误;
C.滴定过程中,溶液出现变色后,立即停止滴定,相当于标准液的体积偏小,根据c(待测)=![]() ,可以知道测定c(HA)偏小,故C错误;
,可以知道测定c(HA)偏小,故C错误;
D.滴定结束后,仰视液面,读取NaOH溶液体积,造成V(标准)偏大,根据c(待测)=![]() ,可以知道测定c(HA)偏大,故D正确。
,可以知道测定c(HA)偏大,故D正确。
故答案为:A D;
(3)根据数据的有效性舍去第3组数据,则1、2组平均消耗V(NaOH)=![]() =21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L,
=21.00mL,根据反应方程式HA+NaOH=NaA+H2O,0.021×0.1000=0.02×c(HA),则c(HA)= 0.1050mol/L,
故答案为:0.1050。

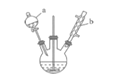
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
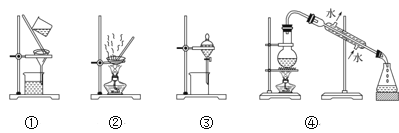
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。
(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。