题目内容
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
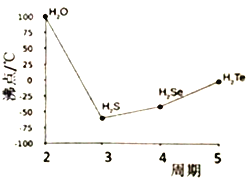
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
【答案】 ![]() 铁失去的是较稳定的3d5的一个电子,钴失去的是3d6上的一个电子 钴的原子半径比钙小,价电子数比钙多,钴中金属键比钙中强 V形 sp3 OF2或Cl2O K+的半径比Na+大,K2S的晶格能比Na2S小 H2O间存在较强的氢键,其它三种不含,所以沸点最高,H2S、H2Se及H2Te的结构相似,相对分子质量不断增大,范德华力不断增强,所以沸点不断升高 (
铁失去的是较稳定的3d5的一个电子,钴失去的是3d6上的一个电子 钴的原子半径比钙小,价电子数比钙多,钴中金属键比钙中强 V形 sp3 OF2或Cl2O K+的半径比Na+大,K2S的晶格能比Na2S小 H2O间存在较强的氢键,其它三种不含,所以沸点最高,H2S、H2Se及H2Te的结构相似,相对分子质量不断增大,范德华力不断增强,所以沸点不断升高 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】(1)Co为27号元素,位于元素周期表第四周期,第八族元素,基态Co原子价电子轨道排布式为![]() 。因为铁容易失去2个电子显+2价,第四电离能是失去的较稳定的3d5的一个电子,而钴失去的是3d6上的一个电子,所以I4(Co) < I4(Fe)。答案:铁失去的是较稳定的3d5的一个电子,钴失去的是3d6上的一个电子。
。因为铁容易失去2个电子显+2价,第四电离能是失去的较稳定的3d5的一个电子,而钴失去的是3d6上的一个电子,所以I4(Co) < I4(Fe)。答案:铁失去的是较稳定的3d5的一个电子,钴失去的是3d6上的一个电子。
(2) 因为CaS3是离子晶体, S32-的几何形状是 V形,中心原子杂化方式是sp3,等电子体是指价电子数和原子数相同的分子离子或原子,所以与S32-互为等电子体的分子是OF2或Cl2O。
(3) K 和Na位于同主族, K的离子半径比 Na离子半径大,Na2S形成的离子键比 K2S的离子键强,K2S的晶格能比Na2S小,所以K2S比 Na2S的熔点低。答案:K2S的晶格能比Na2S小。
(4)S 与O、Se、Te位于同一主族,由图知它们的氢化物的沸点是H2O>H2Te>H2 Se >H2S ,其原因是H2O分子间存在较强的氢键,其它三种不含,所以沸点最高;而H2S、H2Se及H2Te的结构相似,相对分子质量不断增大,范德华力不断增强,所以沸点不断升高。
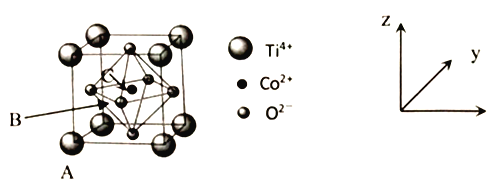
①已知A点的原子坐标参数为为(0,0,0), B点是面心上的点,坐标参数B点为(![]() ,0,
,0,![]() ),C点是体心上的点,以C点分别向三个面做垂线,数值分别距离A点为1/2,所以C点在体心),点的原子坐标参数为(
),C点是体心上的点,以C点分别向三个面做垂线,数值分别距离A点为1/2,所以C点在体心),点的原子坐标参数为(![]() ,
,![]() ,
,![]() )。
)。
②根据晶胞可知:Ti为立方体的顶点,O为立方体面心上的点,Co为立方体体心上的点,化学式为8![]() 1/8=1个Ti 1/2
1/8=1个Ti 1/2![]() 6=3个O, 1个钛,化学式为TiCoO3,其密度为p=m/V
6=3个O, 1个钛,化学式为TiCoO3,其密度为p=m/V
=nM /V,因为晶胞参数为a=0.5485nm,所以晶体的密度为![]() g/cm3 。
g/cm3 。