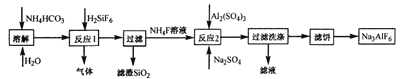
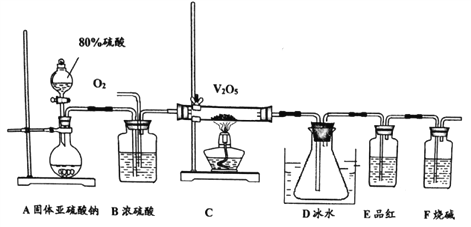
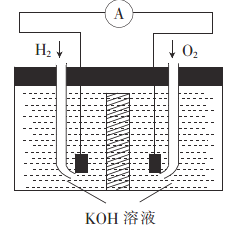
题目内容
【题目】在某温度下,向三个初始体积均为1L的密闭容器中按下表所示投料,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H<0。达到平衡进,下列说法正确的是
2SO3(g)△H<0。达到平衡进,下列说法正确的是
容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的 物质的量/mol | ||
SO2 | O2 | SO3 | |||
Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
A. 平衡时SO3的物质的量:a>1.2、b>1.2
B. 容器Ⅱ、Ⅲ中平衡常数相同
C. 容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
D. 若起始时向容器Ⅰ中充入1.0molSO2(g)、0.40molO2(g)和1.40molSO3(g),则此时V正<V逆
【答案】AC
【解析】A.绝热恒容时,为SO3反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g)△H>0,正反应为吸热反应,温度降低,平衡向生成SO3的方向移动,a>1.2,反应2SO2(g)+O2(g)═2SO3为气体体积减小的反应,恒温恒压时,与原平衡相比相当于压强增大,平衡向生成SO3的方向移动,b>1.2,故A正确;B.平衡常数与温度有关,容器Ⅱ绝热温度会越来越高,容器Ⅲ恒温温度不变,所以容器Ⅱ、Ⅲ温度不同,平衡常数不同,故B错误;C.根据A分析,SO3的转化率减小,即容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故C正确;D.容器 I中反应达到平衡状态时,c(SO3)=1.2mol/L,c(SO2)=
2SO2(g)+O2(g)△H>0,正反应为吸热反应,温度降低,平衡向生成SO3的方向移动,a>1.2,反应2SO2(g)+O2(g)═2SO3为气体体积减小的反应,恒温恒压时,与原平衡相比相当于压强增大,平衡向生成SO3的方向移动,b>1.2,故A正确;B.平衡常数与温度有关,容器Ⅱ绝热温度会越来越高,容器Ⅲ恒温温度不变,所以容器Ⅱ、Ⅲ温度不同,平衡常数不同,故B错误;C.根据A分析,SO3的转化率减小,即容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故C正确;D.容器 I中反应达到平衡状态时,c(SO3)=1.2mol/L,c(SO2)=![]() mol/L=0.8mol/L,c(O2)=
mol/L=0.8mol/L,c(O2)=![]() mol/L=0.4mol/L,化学平衡常数K=
mol/L=0.4mol/L,化学平衡常数K=![]() =5.625,若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),浓度商=
=5.625,若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),浓度商=![]() =4.9<5.625,则该反应向正反应方向移动,则此时V正>V逆,故D错误;故选AC。
=4.9<5.625,则该反应向正反应方向移动,则此时V正>V逆,故D错误;故选AC。

【题目】汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________,N2的电子式___________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
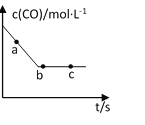
①则反应速率υ(a)、υ(b)、 υ(c)的大小关系是______________;
②下列可说明反应到达图中c点的是__________;
A.NO、CO、CO2、N2表示的速率比值保持2︰2︰2︰1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
【结论】①实验编号Ⅱ的实验目的为_________________________。
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是___________,且____________反应速率将___________。(填“增大”、“减小”、“无影响”)。