题目内容
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定。

(1)氢氧燃料电池能量转化的主要形式是_______(填“电能转化为化学能”或“化学能转化为电能”)。
(2)通入H2的电极为______(填“正极”或“负极”),该电极的电极反应式为____________。
(3)电极表面镀铂粉的原因是____________________。
(4)随着电池不断放电,电解质溶液的碱性________(填“增强”“减弱”或“不变”)。
【答案】 化学能转化为电能 负极 H2+2OH- -2e-=2H2O 增大电极表面上单位面积吸附的H2、O2分子数,加快电极反应速率 减弱
【解析】(1)氢氧燃料电池属于原电池,是将化学能转化为电能的装置,所以该燃料电池中能量主要转化形式是化学能转化为电能;
(2)能氧气的极为正极,则通入H2的电极为负极,发生氧化反应,该电极的电极反应式为H2+2OH- -2e-=2H2O;
(3)反应物接触面积越大,反应速率越快,电极表面镀铂粉能增大反应物的接触面积,所以能增大反应速率;
(4)随着电池不断放电,生成的水的质量越来越多,KOH的物质的量不变,但浓度降低,即电解质溶液的碱性减弱。

【题目】在某温度下,向三个初始体积均为1L的密闭容器中按下表所示投料,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H<0。达到平衡进,下列说法正确的是
2SO3(g)△H<0。达到平衡进,下列说法正确的是
容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的 物质的量/mol | ||
SO2 | O2 | SO3 | |||
Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
A. 平衡时SO3的物质的量:a>1.2、b>1.2
B. 容器Ⅱ、Ⅲ中平衡常数相同
C. 容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
D. 若起始时向容器Ⅰ中充入1.0molSO2(g)、0.40molO2(g)和1.40molSO3(g),则此时V正<V逆
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

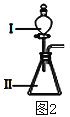
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。



