题目内容
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
(1)D原子结构示意图为 _______ ,A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
a.比较两种单质的颜色
b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置
d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。
(1)  第二周期第ⅤA族
第二周期第ⅤA族
(2)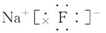 (3)F->Al3+
(3)F->Al3+
(4)a、e (5)NCl3
解析

练习册系列答案
相关题目
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
| 元素 | 相关信息 |
| W | W的基态原子L层电子数是K层电子数的3倍 |
| X | X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y | 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z | Z的基态原子外围电子排布式为(n-1)d10ns1 |
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是 。
(2)W的简单离子半径 X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的 (填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是 (填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为 。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
(任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是 。
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | E | R | F | |
| 3 | A | C | D | H | | I | G |
| 4 | B | | | | | | |
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。
A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
| 元素 | 有关性质或结构信息 |
| A | 雷雨天大气中会有A的一种单质生成 |
| B | B离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D是制造黑火药的一种成分,也可用于杀菌消毒 |
| E | E与D同周期,且在该周期中原子半径最小Ks5u |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)A与C以原子个数比为1:1形成的化合物的电子式为 ,将0.6 mol该化合物投入到100 mL 3 mol/L BE3溶液中的离子方程式为 , 。
(2)F的氢化物是由 (极性或非极性)键形成的 (极性或非极性)分子,写出实验室制备该氢化物的化学方程式 。
(3)下图可用于实验证明D、E的非金属性的强弱。
① 溶液a和b分别为 , (写化学式)。
②溶液a与固体a反应的离子方程式为 。
③非金属性D E(填大于或小于),请从原子结构的角度解释原因 。
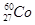 的衰变方程式为
的衰变方程式为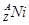 +
+ +Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
+Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。