题目内容
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一段时间后加热铜丝。
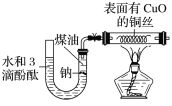
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象________。
(2)U形管中溶液的颜色_____,说明有__________生成。
(3)铜丝的变化现象____________,说明有________生成;若去掉后面的装置,简述检验气体的方法____
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是_______。
【答案】在水和煤油的界面上逐渐变小并作上下跳动 从上到下逐渐由无色变为红色 NaOH 由黑色变红色 H2 在玻璃管口处点燃气体,有淡蓝色火焰产生 ![]() ×100%
×100%
【解析】
该实验的目的是检验钠与水的反应产物。观察装置,左边的U形管中有H2产生(2Na+2H2O=2NaOH+H2↑);在水中滴加了酚酞,若溶液变红,可以证明有NaOH生成;若铜丝表面由黑色变为红色,可以说明有H2生成。
(1)钠的密度比水小,比煤油大;钠与水接触后会产生H2(2Na+2H2O=2NaOH+H2↑),并被H2推起来,又由于重力的作用,钠块会称降到水和没有的界面上,再次与水接触产生H2,就这样不断往复地在水和没有的界面上上下跳动,由于每次跳动都有H2生成,所以可以看到钠块不断被消耗,逐渐变小,直至消失;
(2)钠和水反应有NaOH生成,故可以看到U形管中的溶液变红,故可以通过该现象证明有NaOH生成;
(3)钠和水反应有H2生成,H2可以在加热的条件下还原CuO为Cu,对应的现象是黑色固体变红,故可以通过铜丝表面颜色的变化来证明有H2生成;检验H2的方法还有其他,比如:①用试管收集气体之后,对准燃着的酒精灯,松开手指可以听到爆鸣声,也可以②通过观察燃烧时火焰的颜色,淡蓝色的火焰可以证明有H2生成;
(4)根据反应的现象可以推出水一定是过量的,故需要通过Na的质量来计算反应各体系消耗和生成的量:
2Na+2H2O=2NaOH+H2↑
2×23 2×40 2
a g ![]() g
g ![]() g
g
则w(NaOH)=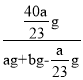 ×100%=
×100%=![]() ×100%。
×100%。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可用做供氧剂。
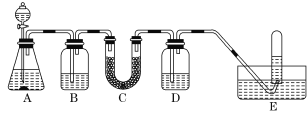
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:______。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
C | Na2O2 | _______ |
D | NaOH溶液 | _______ |
(3)写出Na2O2与CO2反应的化学方程式:______。
(4)试管中收集满气体后,下一步实验操作及现象、结论是___。