题目内容
【题目】一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2接好线路发现灯泡亮,由此得出的结论正确的是
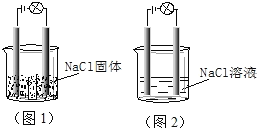
A. NaCl是非电解质
B. NaCl溶液是电解质
C. NaCl在水溶液中电离出了可以自由移动的离子
D. NaCl溶液中产生了电子
【答案】C
【解析】
根据原电池的工作原理和构成条件:电解质溶液必须含有大量自由移动离子,电解质中阴阳离子的定向移动形成电流,在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下都不导电的化合物是非电解质,含有自由移动的离子或电子的物质能导电,据此答题。
A.NaCl晶体中不含自由移动的阴阳离子或电子,所以不导电,但NaCl在熔融状态下能导电,所以属于电解质,故A错误;
B.氯化钠溶液含有自由移动的离子,所以能得电子,但NaCl溶液是混合物,既不是电解质也不是非电解质,故B错误;
C.NaCl在水溶液中电离出了可以自由移动的离子,所以NaCl溶液能导电,故C正确;
D.氯化钠在水分子的作用下电离出阴阳离子,没有产生电子,故D错误。
故选C。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目