题目内容
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在标况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
B.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
C.0.1molNa2O2晶体中含有0.4NA个离子
D.常温常压下,16gO3所含的电子数为8NA
【答案】D
【解析】
A.标况下,11.2L的NO和O2均为0.5mol,混合后NO被O2氧化生成0.5molNO2,并剩余0.25molO2;由于NO2会发生可逆反应:![]() ,所以最终容器中分子的数目:
,所以最终容器中分子的数目:![]() ,A项错误;
,A项错误;
B.氢气是反应过程中的仅有的还原产物,所以生成1molH2,转移电子2mol,B项错误;
C.0.1molNa2O2晶体中含有0.2NA的Na+和0.1NA的![]() ,所以C项错误;
,所以C项错误;
D.16gO3含有1NA个O原子,每个氧原子含有8个电子,所以共计8NA个电子,D项正确;
答案选D。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】磁性材料产业是21 世纪各国竞相发展的高科技支柱产业之一,碳酸锰(MnCO3)可制造电信器材的软磁铁氧体。工业上利用软锰矿(主要成分为 MnO2,含少量SiO2、Fe2O3、CuO 等杂质)和含SO2的烟气为主要原料制备无水碳酸锰的工艺流程如下:

已知:①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃ 时开始分解。
②不同金属离子生成氢氧化物沉淀的 pH 和有关物质的 Ksp 如下表:
离子 | Fe3+ | Fe2+ | Cu2+ | Mg2+ | ||||
开始沉淀的pH | 2.7 | 7.5 | 4.2 | 7.8 | ||||
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 9.8 | ||||
物质 | MnS | CaF2 | CuS | |||||
Ksp | 2.5×10-13 | 1.5×10-10 | 1.3×10-36 | |||||
回答下列问题:
(1)为提高“溶浸”过程中的浸取速率,以下方法不能提高浸取速率的是________。
A.将矿石研磨粉碎 B.连续搅拌 C.延长浸取时间 D.升高温度 E.适当增大稀硫酸的浓度
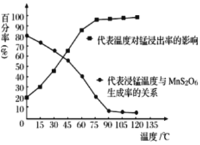
“溶浸”过程中往往有副产物MnS2O6 生成,温度对“溶浸”反应的影响如下图所示, 为减少MnS2O6的生成,“溶浸”的适宜温度应大于___。
(2)“除铁”步骤中,在加入石灰调节溶液的pH前,加入适量的软锰矿,发生反应的离子方程为____。
(3) “净化”步骤的目的是除去溶液中的Ca2+、Cu2+等杂质。若测得滤液中 c(F-)=0.02molL-1,则滤液中残留的c(Ca2+) =__。
(4) “沉锰”步骤中 ,加入 NH4HCO3后有无色无味的气体放出, 发生反应的离子方程式为______。
(5)从“沉锰”步骤中要得到纯净无水MnCO3,先将析出的 MnCO3沉淀过滤,再用_______(填化学式)洗涤更易于干燥。过滤后废液的主要成分为____(填化学式)。
(6)实际生产中, 运用阴离子交换膜法电解得到金属锰,电解装置如下图所示,B电极为直流电源的_________极。该工艺若不使用离子交换膜, 会造成Mn2+发生副反应生成 MnO2, 写出该副反应的电极反应式_______。