题目内容
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是
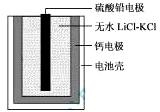

| A.正极反应式:Ca + 2Cl--2e- = CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.每转移0.1mol电子,理论上生成20.7 g Pb |
| D.常温时,在正负极间接上电流表或检流计,指针不偏转 |
D
A、正极发生还原反应,故为PbSO4+2e-=Pb+SO42-,错误;B、放电过程为原电池,阳离子向正极移动,错误;C、每转移0.1mol电子,生成0.05mol Pb,为10.35g,错误;D、常温下,电解质不能融化,不能形成原电池,故指针不偏转,正确。
【考点定位】考查电化学基本理论,涉及电极判断、电极反应方程式的书写、离子流动方向以及简单计算。
【考点定位】考查电化学基本理论,涉及电极判断、电极反应方程式的书写、离子流动方向以及简单计算。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。