题目内容
结合下图判断,下列叙述正确的是
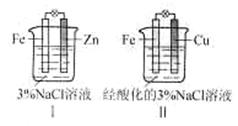

| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
A
锌比铁活泼,装置Ⅰ中锌作负极,方程式为Zn-2e-=Zn2+。铁作正极,但溶液显中性,所以发生锌的吸氧腐蚀,正极反应是O2+2H2O+4e-=4OH-;铁比铜活泼,装置Ⅱ中铁作负极,负极反应为Fe-2e-=Fe2+。铜作正极,但溶液显酸性,所以正极是溶液中的氢离子得电子,方程式为2H++2e-=H2↑。因为装置Ⅰ中没有Fe2+生成,所以装置Ⅰ中加入少量K3Fe(CN)6溶液时,没有蓝色沉淀产生。综上所叙,只有选项A是正确的。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目

 Li2CoO2,下列说法不正确的是
Li2CoO2,下列说法不正确的是