题目内容
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
(共6分)0.05 mol· (L·min)-1 0.175 mol·L-1 4(各2分)
试题分析:2 min末已生成0.3 mol W
则用W表示的反应速率是

由于反应速率之比是相应的化学计量数之比
所以前2 min内用X的浓度变化表示的平均反应速率为

又因为以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1
所以n=4
反应中消耗Y的物质的量是
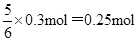
所以2 min末时Y的浓度为(0.6mol-0.25mol)÷2L=0.175mol/L
点评:该题是基础性试题的考查,难度不大。试题基础性强,侧重对学生基础知识的巩固和训练,旨在培养学生的逻辑推理能力和规范的答题能力,也有利于提高学生的应试能力和学习效率。该题的关键是利用好反应速率之比是相应的化学计量数之比。

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为 2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是( )
2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是( ) 2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是
2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是