题目内容
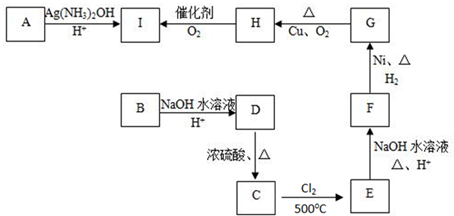
物质的转化关系如下图所示(有的反应可能在水溶液中进行).其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成.请回答下列问题:
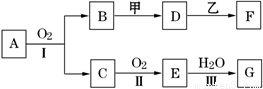
请回答些列问题:
(1)写出甲的电子式是 .
(2)写出反应Ⅰ的化学方程式 .
(3)A溶于水得到得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为 用含a和b的代数式表示出该混合溶液中X的电离平衡常数 .
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图装置处理污水.
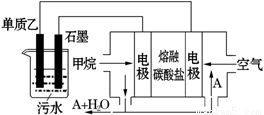
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ. ;Ⅱ. .
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是 .
(每空2分,共14分)
(1)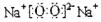 (2分) (2)4NH3+5O2
(2分) (2)4NH3+5O2 4NO+6H2O
(2分)
4NO+6H2O
(2分)
(3)c(NO3—)=c(NH4+)>c(OH—)= c(H+) ; 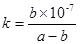 (各2分,共4分)
(各2分,共4分)
(4)①Al-3e— = Al3— ; 4OH- - 4e-= 2H2O + O2↑ ②CO2 (各2分,共6分)
【解析】
试题分析:
(1)由题干信息可知甲为过氧化钠;
(2)反应Ⅰ涉及氨的催化氧化;
(3)溶液X为氨水。如果溶液呈中性,则氨水过量,混合后的溶质为NH4NO3和NH3·H2O,根据溶液中电荷守恒,可得:c(NO3—)=c(NH4+)>c(OH—)= c(H+)
NH3·H2O
 NH4+ + OH—
NH4+ + OH—
K = 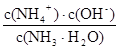
c(NH4+)= c(NO3—)=b mol·L-1 ; c(OH—)=10-7 mol·L-1 ; c(NH3·H2O)=(a – b) mol·L-1
代入计算可得答案。
(4)单质乙为Al,非惰性电极做阳极,优先放电,同时OH—在阳极也会放电。
熔融的碳酸盐为电解质,则正极反应为:2O2 + 8 e- + 4CO2 = 4CO32-
负极反应为:CH4 – 8 e- +4CO32- = 5CO2 + 2H2O
所以必须有CO2参与循环反应。
考点:本题考查了溶液中三个守恒关系式,化学平衡常数的计算,电极反应方程式的书写等,综合性比较强,要求学生分析问题,提取题干信息的能力。

 阅读快车系列答案
阅读快车系列答案
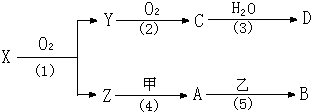
 中学化学中几种常见物质的转化关系如下图(部分产物未列出).A是一种金属单质,D是一种非金属固体单质.
中学化学中几种常见物质的转化关系如下图(部分产物未列出).A是一种金属单质,D是一种非金属固体单质.