题目内容
已知X是由两种元素组成的化合物.物质的转化关系如下图所示(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明):
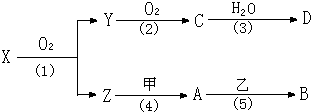
(1)若甲为淡黄色的固体,B为一种蓝色沉淀,用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成.请回答下列问题:
①写出D的化学式
②写出反应(1)的化学方程式
③写出反应(5)的离子方程式
(2)若Z为红棕色的固体,甲为一种金属单质,甲与A含有同一种元素,且甲在D的浓溶液中发生钝化现象,Y能使品红溶液退色.请回答下列问题:
①化合物X中含有的元素是(填元素符号)
②若乙为强碱溶液,写出反应(5)的离子方程式
③写出反应(4)的化学方程式

(1)若甲为淡黄色的固体,B为一种蓝色沉淀,用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成.请回答下列问题:
①写出D的化学式
HNO3
HNO3
.②写出反应(1)的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| 高温高压 |
4NH3+5O2
4NO+6H2O
.
| ||
| 高温高压 |
③写出反应(5)的离子方程式
Cu2++2OH-=Cu(OH)2
Cu2++2OH-=Cu(OH)2
.(2)若Z为红棕色的固体,甲为一种金属单质,甲与A含有同一种元素,且甲在D的浓溶液中发生钝化现象,Y能使品红溶液退色.请回答下列问题:
①化合物X中含有的元素是(填元素符号)
Fe、S
Fe、S
.②若乙为强碱溶液,写出反应(5)的离子方程式
Al2O3+2OH-+3H2O=2[Al(OH)4]-
Al2O3+2OH-+3H2O=2[Al(OH)4]-
.③写出反应(4)的化学方程式
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
.
| ||
分析:(1)用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知X为NH3,则Y为NO,C为NO2,D为HNO3,Z为H2O,甲为淡黄色的固体,应为Na2O2,B为一种蓝色沉淀,应为Cu(OH)2,则A为NaOH,乙为可溶性铜盐溶液;
(2)Y能使品红溶液退色,应为SO2,C为SO3,D为H2SO4,Z为红棕色的固体,且应为氧化物,应为Fe2O3,甲为一种金属单质,甲与Fe2O3发生铝热反应,应为Al,可与A含有同一种元素,A为Al2O3,具有两性,乙为强碱溶液,二者可反应生成[Al(OH)4]-.
(2)Y能使品红溶液退色,应为SO2,C为SO3,D为H2SO4,Z为红棕色的固体,且应为氧化物,应为Fe2O3,甲为一种金属单质,甲与Fe2O3发生铝热反应,应为Al,可与A含有同一种元素,A为Al2O3,具有两性,乙为强碱溶液,二者可反应生成[Al(OH)4]-.
解答:解:(1)用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知X为NH3,则Y为NO,C为NO2,D为HNO3,Z为H2O,甲为淡黄色的固体,应为Na2O2,B为一种蓝色沉淀,应为Cu(OH)2,则A为NaOH,乙为可溶性铜盐溶液,
①由以上分析可知D为HNO3,故答案为:HNO3;
②X为NH3,在催化剂条件下可与氧气发生反应,为工业制硝酸的重要反应,方程式为4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
③反应(5)可溶性铜盐溶液与碱的反应,离子方程式为Cu2++2OH-=Cu(OH)2,故答案为:Cu2++2OH-=Cu(OH)2;
(2)Y能使品红溶液退色,应为SO2,C为SO3,D为H2SO4,Z为红棕色的固体,且应为氧化物,应为Fe2O3,甲为一种金属单质,甲与Fe2O3发生铝热反应,应为Al,可与A含有同一种元素,A为Al2O3,具有两性,乙为强碱溶液,二者可反应生成[Al(OH)4]-,
①由以上分析可知化合物X中含有的元素是Fe、S,故答案为:Fe、S;
②A为Al2O3,具有两性,乙为强碱溶液,二者可反应生成[Al(OH)4]-,
离子方程式为Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
③铝与Fe2O3发生铝热反应,方程式为Fe2O3+2Al
Al2O3+2Fe,
故答案为:Fe2O3+2Al
Al2O3+2Fe.
①由以上分析可知D为HNO3,故答案为:HNO3;
②X为NH3,在催化剂条件下可与氧气发生反应,为工业制硝酸的重要反应,方程式为4NH3+5O2
| ||
| 高温高压 |
故答案为:4NH3+5O2
| ||
| 高温高压 |
③反应(5)可溶性铜盐溶液与碱的反应,离子方程式为Cu2++2OH-=Cu(OH)2,故答案为:Cu2++2OH-=Cu(OH)2;
(2)Y能使品红溶液退色,应为SO2,C为SO3,D为H2SO4,Z为红棕色的固体,且应为氧化物,应为Fe2O3,甲为一种金属单质,甲与Fe2O3发生铝热反应,应为Al,可与A含有同一种元素,A为Al2O3,具有两性,乙为强碱溶液,二者可反应生成[Al(OH)4]-,
①由以上分析可知化合物X中含有的元素是Fe、S,故答案为:Fe、S;
②A为Al2O3,具有两性,乙为强碱溶液,二者可反应生成[Al(OH)4]-,
离子方程式为Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
③铝与Fe2O3发生铝热反应,方程式为Fe2O3+2Al
| ||
故答案为:Fe2O3+2Al
| ||
点评:本题考查无机物的推断和元素化合物知识,侧重于学生分析能力的考查,做题时注意找出题目的突破口是做题的关键,注意积累基础知识,题目难度不大.

练习册系列答案
相关题目
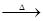 Z+W
Z+W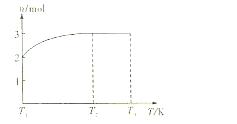
 Z+W
Z+W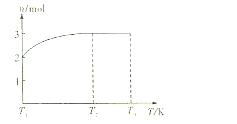
 混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气 L。(设空气组成为:N2与O2,体积比4:1)
混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气 L。(设空气组成为:N2与O2,体积比4:1)