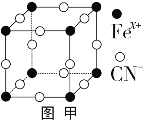
题目内容
【题目】常温下,向100mL0.01molL-1HA溶液中逐滴加入0.02molL -1MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)。下列说法中不正确的是( )

A.MOH为一元弱碱
B.MA稀溶液pH<7
C.N点水的电离程度大于K点水的电离程度
D.K点对应的溶液的pH=10,则c(MOH)+c(OH)-c(H+)=0.01molL-1
【答案】D
【解析】
A.0.01molL-1HA溶液中pH=2,则HA是强酸,滴入50mlMOH溶液恰好反应后,据图可知此时溶液呈酸性,说明存在M+水解使溶液显酸性,则MOH为弱碱,故A正确;
B.HA是强酸,MOH为弱碱,MA是强酸弱碱盐,其稀溶液pH<7,故B正确;
C.由图象可知,N点溶液呈中性,水电离的氢离子为10-7mol/L,K点溶液呈碱性,MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/L,所以N点水的电离程度大于K点水的电离程度,故C正确;
D.在K点时混合溶液体积是MOH溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01molL-1,c(A-)=0.005 molL-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),联立可得c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01molL-1-0.005molL-1=0.005molL-1,故D错误;
故选:D。

【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应①的化学平衡常数K表达式为________;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
图1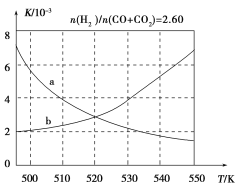
图2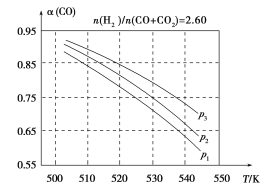
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________________________;图2中的压强由大到小为________,其判断理由是____________。
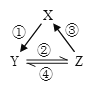
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D