题目内容
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、1mol?L-1的K2SO4溶液中有2NA个K+ |
| B、1mol Cl2与足量铁反应,转移2NA个电子 |
| C、标准状况下,22.4L氨气溶于水,此溶液中含有NA个NH3分子 |
| D、所含溶质为63g的浓硝酸与足量的铜反应,生成的气体分子数为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.缺少硫酸钾溶液的体积,无法计算溶液中钾离子的数目;
B.1mol氯气与足量铁反应最多得到2mol电子;
C.氨气溶于水生成一水合氨,溶液中存在的氨气分子数目较少;
D.63g硝酸的物质的量为1mol,浓硝酸随着反应的进行会逐渐变成稀硝酸,根据反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O进行判断.
B.1mol氯气与足量铁反应最多得到2mol电子;
C.氨气溶于水生成一水合氨,溶液中存在的氨气分子数目较少;
D.63g硝酸的物质的量为1mol,浓硝酸随着反应的进行会逐渐变成稀硝酸,根据反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O进行判断.
解答:
解:A.没有告诉硫酸钾溶液的体积,无法计算溶液中钾离子的数目,故A错误;
B.1mol Cl2与足量铁反应转移了2mol电子,转移2NA个电子,故B正确;
C.标准状况下,22.4L氨气的物质的量为1mol,氨气溶于水生成一水合氨,溶液中含有的氨气分子较少,此溶液中含有氨气分子数目一定小于NA,故C错误;
D.铜与浓硝酸反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,铜与稀硝酸反应的方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,63g硝酸的物质的量为1mol,1mol浓硝酸完全反应生成0.5mol二氧化氮,1mol稀硝酸与铜反应生成0.25mol一氧化氮,所以1mol浓硝酸与足量铜反应生成的气体的物质的量小于0.5mol,生成的气体分子数小于0.5NA,故D错误;
故选B.
B.1mol Cl2与足量铁反应转移了2mol电子,转移2NA个电子,故B正确;
C.标准状况下,22.4L氨气的物质的量为1mol,氨气溶于水生成一水合氨,溶液中含有的氨气分子较少,此溶液中含有氨气分子数目一定小于NA,故C错误;
D.铜与浓硝酸反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,铜与稀硝酸反应的方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,63g硝酸的物质的量为1mol,1mol浓硝酸完全反应生成0.5mol二氧化氮,1mol稀硝酸与铜反应生成0.25mol一氧化氮,所以1mol浓硝酸与足量铜反应生成的气体的物质的量小于0.5mol,生成的气体分子数小于0.5NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项AD为易错点,注意A中缺少溶液体积、D中浓硝酸随着反应的进行会变成稀硝酸.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
| A、①② | B、①④ | C、①③ | D、②③ |
观察如图几个装置示意图,有关叙述正确的是( )
A、装置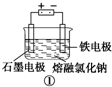 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 |
B、装置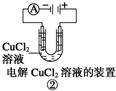 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 |
C、装置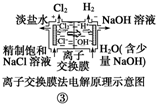 中的离子交换膜只允许阳离子、阴离子和小分子水通过 中的离子交换膜只允许阳离子、阴离子和小分子水通过 |
D、装置 的待镀铁制品应与电源正极相连 的待镀铁制品应与电源正极相连 |
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放的能量相当于目前人类一年消耗的总能量.在地球上,氦元素主要以42He的形式存在.下列说法正确的是( )
| A、42He比32He是同种原子的不同表示形式 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有2个中子 |
| D、42He与32He的质量数相等 |
下列有关物质的分类或归类正确的是( )
①混合物:冰醋酸、水玻璃、水银 ②化合物:CaCl2、烧碱、聚乙烯
③电解质:明矾、胆矾、硫酸钡 ④同素异形体:C60、金刚石、石墨
⑤同位素:1H、2H、3H.
①混合物:冰醋酸、水玻璃、水银 ②化合物:CaCl2、烧碱、聚乙烯
③电解质:明矾、胆矾、硫酸钡 ④同素异形体:C60、金刚石、石墨
⑤同位素:1H、2H、3H.
| A、①③④ | B、③④⑤ |
| C、②③④ | D、②④⑤ |
下列表示对应反应的离子方程式正确的是( )
| A、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | ||||
| B、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ | ||||
| C、碳酸氢钠的水解:HCO3-+H2O?CO32-+H3O+ | ||||
D、用惰性电极电解氯化镁溶液:2Cl-+2H2O
|
下列说法正确的是( )
| A、强电解质溶液的导电能力比弱电解质强 |
| B、难溶盐如:BaSO4、CaCO3、AgCl等是弱电解质,易溶性盐如:醋酸铵是强电解质 |
| C、在水溶液中是否完全电离是判断强弱电解质的依据 |
| D、二氧化硫溶于水可以导电,所以二氧化硫是电解质 |