题目内容
【题目】有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。A是所有元素中原子半径最小的元素。B、C、D同周期且相邻,C的气态氢化物的水溶液显碱性。E是同周期元素中金属性最强的元素。F的氧化物既能溶于强酸又能溶于强碱。G的一种氧化物能使品红溶液褪色,且G原子的M层电子数是K层电子数的3倍。按要求回答下列向题:
(1) C元素在周期表中位置_________;F原子的原子结构示意图是________。
(2)E与D形成的化合物E2D2的电子式是_______;B与D形成的化合物BD2的结构式是_____。
(3)B、G、H三种元素最高价氧化物的水化物的酸性从强到弱的顺序是________。E所在的周期中离子半径最小的是________。(用相应酸的化学式或离子符号回答问题)
(4)G的一种氧化物能使酸性高锰酸钾溶液褪色,对应的离子方程式_________。
【答案】 第二周期第ⅤA族 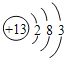
![]() O=C=O HClO4>H2SO4>H2CO3 Al3+ 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
O=C=O HClO4>H2SO4>H2CO3 Al3+ 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
【解析】A是所有元素中原子半径最小的元素,则A是氢元素;B、C、D同周期且相邻,C的气态氢化物的水溶液显碱性,C的氢化物为NH3,则B为C元素、C为N元素、D为氧元素;E是同周期元素中金属性最强的元素,则E为钠元素;F的氧化物既能溶于强酸又能溶于强碱,则F为Al元素;G的一种氧化物能使品红溶液褪色,且G原子的M层电子数是K层电子数的3倍,可知G为S元素,则H为Cl元素;
(1) 氮的核电荷数为7,则氮元素在周期表中位置为第二周期第ⅤA族;Al原子的原子结构示意图是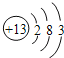 ;
;
(2)Na与O形成的化合物Na2O2的电子式是 ;CO2是直线形非极性分子,其结构式是O=C=O;
;CO2是直线形非极性分子,其结构式是O=C=O;
(3)C、S、Cl三种元素中氯元素非金属性最强,碳元素非金属性最弱,则三者最高价氧化物的水化物的酸性从强到弱的顺序是HClO4>H2SO4>H2CO3;Na为第三周期元素,Na+、Mg2+、Al3+的离子结构相同,核电荷数大,离子半径小,而S2-、Cl-等比Na+多一个电子层,离子半径大,则Na所在的周期中离子半径最小的是Al3+ ;
(4)SO2能酸性高锰酸钾溶液褪色,体现SO2有还原性,对应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。

 小学课时特训系列答案
小学课时特训系列答案