题目内容
【题目】短周期中的四种主族元素A、B、C、D、E,原子序数依次增大。A是电负性最大的元素,B、D的价电子层中均有两个未成对电子,回答下列问题:
(1)B元素在周期表中的位置为___________________________;
(2)A的基态原子中,电子占据的最高能级符号为___;该能级的电子云轮廓图形状为__________;
(3)B、C、D三种元素的第一电离能大小顺序为________;该电离能大小变化的原因为________________;
(4)C、D、E三种元素的最高价氧化物的水化物的酸性强弱顺为________________。
【答案】第三周期ⅣA族 2p 哑铃形(纺锤形) Si<S<P S与Si相比较,S半径小,核电荷数大,S原子对电子吸引能力更强,因此第一电离能S>Si;而P原子的2p能级为半充满,较稳定,较难失去第一个电子,因此第一电离能P>S HClO4>H2SO4>H3PO4
【解析】
短周期中的四种主族元素,原子序数依次增大。A是电负性最大的元素,A是F;B、D的价电子层中均有两个未成对电子, B是Si,D是S; C介于Si和S之间,是P;短周期中的四种主族元素原子序数依次增大,则E是Cl。
(1)B是Si,14号元素,第三周期ⅣA族
(2)氟原子的电子排布图![]() ,电子占据的最高能级符号为2p,该能级的电子云轮廓图形状为哑铃形(纺锤形);
,电子占据的最高能级符号为2p,该能级的电子云轮廓图形状为哑铃形(纺锤形);
(3)S与Si相比较,S半径小,核电荷数大,S原子对电子吸引能力更强,因此第一电离能S>Si;而P原子的2p能级为半充满,较稳定,较难失去第一个电子,因此第一电离能P>S>Si
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,Cl、S、P三种元素的最高价氧化物的水化物分别为H3PO4、H2SO4 、HClO4,所以其最高价氧化物的水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4。

【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)①铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是___ (填字母)。
A. 电子从基态跃迁到较高的激发态 B. 电子从较高的激发态跃迁到基态
C. 焰色反应的光谱属于吸收光谱 D. 焰色反应的光谱属于发射光谱
②碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
(2)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
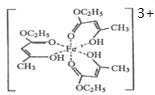
①此配合物中,基态铁离子的价电子排布图为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A.σ键 B.π键 C.极性键 D.非极性键 E. 配位键 F. 氢键 G.离子键
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_____________。
(4)治疗铅中毒可滴注依地酸(别名EDTA,结构如下面左图)钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_________(填标号)
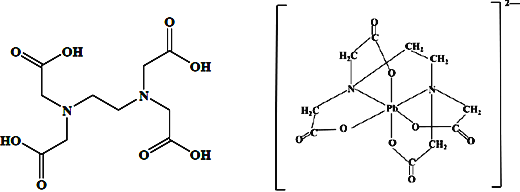
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
(5)AlCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,一个分子中的氯原子与另外一个铝原子形成配位键,因此以二聚体Al2Cl6的形式存在,写出Al2Cl6的结构式_______(用→标出配位键)。