题目内容
15.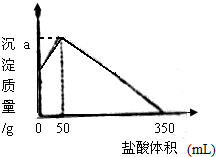 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示,根据题意回答下列问题:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示,根据题意回答下列问题:(1)写出将NaOH、AlCl3、MgCl2溶于水时发生反应的离子方程式:Al3++3OH-=Al(OH)3↓,Mg2++OH-=Mg(OH)2、Al3++4OH-=AlO2-+2H2O
(2)a的值为24.3g;
(3)求出原混合物各成分的物质的量(要求写出计算过程).
分析 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中加入盐酸时,加入50mL盐酸时沉淀量达到最大,则偏铝酸离子完全转化为氢氧化铝沉淀,a点为白色沉淀为Mg(OH)2和Al(OH)3,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,根据离子方程计算n[Al(OH)3],再根据Al元素守恒计算n(AlCl3);
加入50-350mL盐酸,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,溶液中的溶质是氯化铝、氯化镁和氯化钠,据此计算即可.
解答 解:将NaOH、AlCl3、MgCl2溶于水,加入盐酸后继续生成沉淀,说明氢氧化钠没有剩余,此三者之间的离子反应式为:Al3++3OH-=Al(OH)3↓,Mg2++OH-=Mg(OH)2↓、以及部分铝生成偏铝酸根,Al3++4OH-=AlO2-+2H2O,由图可知,0-50mL阶段发生反应:H2O+AlO2-+H+=Al(OH)3↓,需要盐酸的物质的量=0.05L×3mol/L=0.15mol,此时生成氢氧化铝沉淀的物质的量=0.15mol,质量m=0.15mol×78g/mol=11.7g,那么a=11.7+12.6=24.3g;350mL盐酸时,溶质为氯化铝、氯化镁和氯化钠,即氢氧化钠消耗盐酸为350mL,那么NaOH的物质的量=0.35L×3mol/L=1.05mol,设氢氧化铝沉淀与氢氧化镁沉淀的物质的量分别为x和y,依据题意有$\left\{\begin{array}{l}{78x+58y=12.6g}\\{3x+2y+0.15mol×4=1.05mol}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.05mol}\\{y=0.15mol}\end{array}\right.$,据此得出原混合物中NaOH、AlCl3、MgCl2的物质的量分别为1.05mol、0.05mol+0.15mol=0.2mol和0.15mol,故答案为:(1)Al3++3OH-=Al(OH)3↓,Mg2++OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O;(2)24.3g;(3)1.05mol、0.2mol和0.15mol.
点评 根据滴加稀盐酸与产生沉淀的关系图,分析各阶段所发生的反应,利用各阶段反应的化学方程式进行相关物质质量的计算;本题所涉及的反应比较复杂,在分析时逐个反应梳理清楚是解决本问题的关键.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | 0.8mol•L-1 | B. | 0.4mol•L-1 | C. | 0.08mol•L-1 | D. | 0.04mol•L-1 |
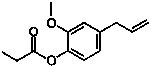 如图的有机物,则该有机物可发生的反应类型有( )
如图的有机物,则该有机物可发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚.
| A. | ①②④⑤⑥ | B. | ①②③⑤⑦ | C. | ①②⑤⑥⑦ | D. | ①②④⑤⑦ |

| A. | 其分子式为C15H16O2 | |
| B. | 它有弱酸性,且能和酸性高锰酸钾溶液反应 | |
| C. | 它常温下呈液态,不溶于水,是苯酚的同系物 | |
| D. | 该有机物分子中碳原子不可能在同一平面上 |
| A. | 核内无中子的原子 | |
| B. | 外围电子排布为3s23p3 | |
| C. | 最外层电子数等于倒数第三层的电子数的原子 | |
| D. | N层上无电子,最外层的电子数等于电子层数的金属原子 |
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 共价化合物中只有极性键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 非极性键只存在于单质分子中 |
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题: