题目内容
2.(1)下列物质:①NaCl ②Ba(OH)2 ③CH3COOH ④H2SO4 ⑤CH3CH2OH ⑥H2O⑤是非电解质;①②④是强电解质;③⑥是弱电解质.
(2)25℃时,浓度为0.10mol•L-1的氨水显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-;向氨水中通入HCl,氨水的电离程度增大(填“增大”、“减小”或“不变”),溶液的pH将减小(填“增大”、“减小”或“不变”).
分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,单质和混合物既不是电解质也不是非电解质;能够完全电离的电解质是强电解质,只能部分电离的电解质是弱电解质;
(2)25℃时,NH3•H2O电离出NH4+和OH-而导致溶液中c(OH-)>c(H+),溶液呈碱性;向氨水中通入HCl,发生中和反应,溶液中c(OH-)减小从而促进一水合氨电离,溶液碱性减弱,据此分析解答.
解答 解:(1)①NaCl在水溶液里或熔融状态下能完全电离,属于强电解质;
②Ba(OH)2 在水溶液里或熔融状态下能完全电离,属于强电解质;
③CH3COOH 在水溶液里只能部分电离出自由移动的离子而导电,属于弱电解质;
④H2SO4 在水溶液里能完全电离,属于强电解质;
⑤乙醇是在水溶液里和熔融状态下都不导电的化合物,属于非电解质;
⑥水能部分电离出自由移动的离子而导电,属于弱电解质;
所以属于强电解质的是①②④;
属于弱电解质的是③⑥;
属于非电解质的是⑤.
故答案为:①②④;③⑥;⑤;
(2)25℃时,NH3•H2O电离出NH4+和OH-而导致溶液中c(OH-)>c(H+),所以溶液呈碱性,电离方程式为NH3•H2O?NH4++OH-;向氨水中通入HCl,发生中和反应,溶液中c(OH-)减小从而促进一水合氨电离,溶液碱性减弱,溶液中c(OH-)降低,溶液的pH减小,
故答案为:NH3•H2O?NH4++OH-;增大;减小.
点评 本题考查了电解质和非电解质,强电解质,弱电解质的判断以及弱电解质的电离,题目难度不大,把握电解质、非电解质的概念,判断电解质强弱的依据是解题的关键,注意单质和混合物既不是电解质也不是非电解质.

练习册系列答案
相关题目
12.一定条件下某有机分子可发生如图所示的变化,下列关于两物质的叙述不正确的是( )
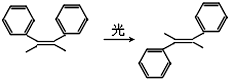

| A. | 分子式相同,互为同分异构体 | |
| B. | 均可发生加聚反应、氧化反应 | |
| C. | 均含有苯环,都是苯的同系物 | |
| D. | 分子中所有碳原子均可能处于同一平面上 |
13.关于同温同压下相同体积的CO和CO2,下列有关叙述不正确的是( )
| A. | 物质的量相等 | B. | 所含分子数相等 | ||
| C. | 质量相等 | D. | 所含碳原子数相等 |
7.下列有关热化学方程式的叙述中,正确的是( )
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知2H2O(g)═2H2(g)+O2(g)△H=+483.6 kJ•mol-1,则提供483.6 kJ热量时,一定会使2 mol H2O (g)发生分解 | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)═2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)═2CO2(g)△H=(2a-b) kJ•mol-1 |
14.关于平衡常数,下列说法正确的是( )
| A. | 使用催化剂能使化学反应速率加快,平衡常数增大 | |
| B. | 平衡常数随温度的改变而改变 | |
| C. | 化学平衡发生移动,平衡常数必发生变化 | |
| D. | 对于3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为K=$\frac{c(F{e}_{3}{O}_{4})•{c}^{4}({H}_{2})}{c(Fe)•{c}^{4}({H}_{2}O)}$ |
11.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系错误的是( )
| A. | c(HX)>c(X-) | B. | c(HX)+c(H+)=c(Na+)+c(OH-) | ||
| C. | c(X-)+c(HX)=2c(Na+) | D. | c(OH-)<c(H+) |
12.有100mL MgCl2和AlCl3的混合液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分离,至少需要2mol/L NaOH溶液的体积为( )
| A. | 80 mL | B. | 100 mL | C. | 120 mL | D. | 110 mL |