题目内容
【题目】钼酸钠晶体(Na2MoO42H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如图1: 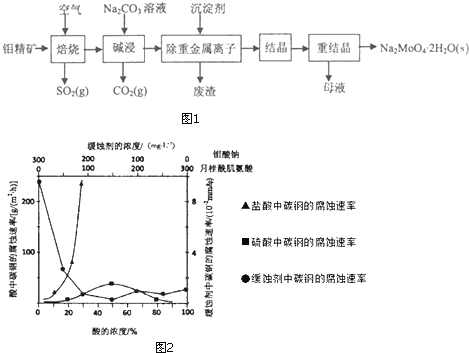
(1)写出“碱浸”反应的离子方程式;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42﹣ . 当BaMoO4开始沉淀时,SO42﹣的去除率是;[已知:碱浸液中c(MoO42﹣)=0.40molL﹣1 , c(SO42﹣)=0.04molL﹣1 , Ksp(BaSO4)=1.1×10﹣10、Ksp(BaMoO4)=4.0×10﹣8 , 加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是;
(4)如图2是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4﹣Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2 . NaNO2的作用是;
③若缓释剂钼酸钠﹣月桂酸肌氨酸总浓度为300mgL﹣1 , 则缓蚀效果最好时钼酸钠的物质的量浓度为 .
【答案】
(1)MoO3+CO32﹣=MoO42﹣+CO2↑
(2)97.3%
(3)使用一定次数后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度
(4)Cl﹣有利于碳钢的腐蚀,SO42﹣不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;替代空气中氧气起氧化剂作用;7.28×l0﹣4mol?L﹣1
【解析】(1)三氧化钼与碳酸钠反应生成了MoO42﹣ , 反应的离子方程式为:MoO3+CO32﹣=MoO42﹣+CO2↑, 所以答案是:MoO3+CO32﹣=MoO42﹣+CO2↑;(2)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)= ![]() =1×10﹣7mol/L,溶液中硫酸根离子的浓度为:c(SO42﹣)=
=1×10﹣7mol/L,溶液中硫酸根离子的浓度为:c(SO42﹣)= ![]() mol/L=1.1×10﹣3mol/L,硫酸根离子的去除率为:1﹣
mol/L=1.1×10﹣3mol/L,硫酸根离子的去除率为:1﹣ ![]() ×100%=1﹣2.75%≈97.3%,
×100%=1﹣2.75%≈97.3%,
所以答案是:97.3%;(3)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理,所以答案是:使用一定次数后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;(4)①由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,
所以答案是:Cl﹣有利于碳钢的腐蚀,SO42﹣不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
②NaNO2的具有氧化性,能够在钢铁表面形成FeMoO4﹣Fe2O3保护膜,
所以答案是:替代空气中氧气起氧化剂作用;
③根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mgL﹣1 ,
1L溶液中含有的钼酸钠物质的量为: ![]() ≈7.28×10﹣4mol,
≈7.28×10﹣4mol,
所以钼酸钠溶液的物质的量浓度为:7.28×l0﹣4molL﹣1 ,
所以答案是:7.28×l0﹣4molL﹣1 .

【题目】Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
元素 | 相关信息 |
Q | Q的单质是实验室常用的惰性电极材料 |
R | R原子基态时2p原子轨道上有3个未成对电子 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
X | X是第三周期电负性最大的元素 |
Y | 元素Y位于周期表第10列 |
Z | Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是
(2)下列叙述正确的是 a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2 . QT分子中σ键π键的个数比为;QT2分子中,Q原子采取杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为 , 且为(填“极性”或“非极性”)分子.
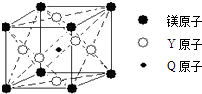
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为;晶体中每个镁原子周围距离相等且最近的Y原子有个.