题目内容
【题目】某天然油脂A的分子式为C37H106O6 , 1mol该油脂水解可得到1molB、2mol一元直链饱和脂肪酸C和1mol一元不饱和脂肪酸D,且C、D分子中碳原子数相同.以A为原料,通过如图的一系列转化关系,可以得到生物柴油G和高分子化合物M. 
已知:
试回答下列问题:
(1)用系统命名法给D命名为;
(2)C的结构简式为;
(3)下列有关生物柴油G的说法正确的是;
a.生物柴油G的主要成分属于烃类
b.生物柴油和石化柴油相比含硫量低,具有优良的环保特性
c.生物柴油是一种可再生能源,其资源不会像石油、煤炭那样会枯竭
d.由于提炼生物柴油的原料可以用地沟油,所以生产生物柴油的成本低,我国已经大面积使用生物柴油来代替矿物油,彻底解决了能源危机问题
(4)上述框图所示的下列物质的转化中,属于消去反应的是;
a、E→G b、D→F c、F→H d、I→J e、J→K F、K→M
(5)写出F→H的转化中,第一步反应的化学方程式;
(6)写出I→J的转化中,第一步反应的化学方程式;
(7)有机物J的一氯取代物(不考虑取代羟基上的氢,不考虑立体异构)有种.
【答案】
(1)9,12﹣十八碳二烯酸
(2)CH3(CH2)16COOH
(3)bc
(4)e
(5)OHCCH2CHO+4Cu(OH)2+2NaOH ![]() NaOOCCH2COONa+2Cu2O↓+6H2O
NaOOCCH2COONa+2Cu2O↓+6H2O
(6)H3COOCCH2COOCH3+4 ![]() →
→ 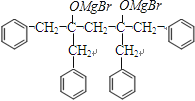 +2CH3OMgBr
+2CH3OMgBr
(7)5
【解析】某天然油脂A的分子式为C57H106O6 , 1mol该油脂水解可得到1molB、2mol一元直链饱和脂肪酸C和1mol一元不饱和脂肪酸D,则B为丙三醇,由于C、D分子中碳原子数相同,则C、D中含有碳原子数为: ![]() =18,C为一元直链饱和脂肪酸,则C为CH3(CH2)16COOH,D为含有18个C的不饱和脂肪酸;结合转化关系中D能够氧化生成CH3(CH2)4CHO、HOOC(CH2)7CHO和F可知,F分子中一定结合两个醛基,且F中含有C的数目为:18﹣9﹣6=3,故F为丙二醛:OHCCH2CHO;根据信息反应1可知,D的结构简式为:CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,名称为9,12﹣十八碳二烯酸;F与新制的氢氧化铜浊液反应、再酸化转化成H,则H为HOOCCH2COOH;H与足量的甲醇发生酯化反应生成I,则I为H3COOCCH2COOCH3;I与
=18,C为一元直链饱和脂肪酸,则C为CH3(CH2)16COOH,D为含有18个C的不饱和脂肪酸;结合转化关系中D能够氧化生成CH3(CH2)4CHO、HOOC(CH2)7CHO和F可知,F分子中一定结合两个醛基,且F中含有C的数目为:18﹣9﹣6=3,故F为丙二醛:OHCCH2CHO;根据信息反应1可知,D的结构简式为:CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,名称为9,12﹣十八碳二烯酸;F与新制的氢氧化铜浊液反应、再酸化转化成H,则H为HOOCCH2COOH;H与足量的甲醇发生酯化反应生成I,则I为H3COOCCH2COOCH3;I与 ![]() 发生信息反应生成
发生信息反应生成 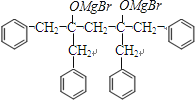 和CH3OMgBr,
和CH3OMgBr, 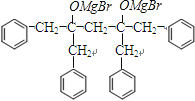 发生水解反应生成J:
发生水解反应生成J: 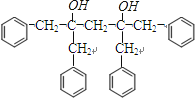 ;J在浓硫酸作用下发生消去反应生成K,K发生加聚反应生成M;B为甘油,C为CH3(CH2)16COOH,二者发生酯化反应生成酯E,E再与据此发生酯化反应生成酯G,(1)D的结构简式为:CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,羧基在1号C,碳碳双键在9、12号C,该有机物名称为:9,12﹣十八碳二烯酸,所以答案是:9,12﹣十八碳二烯酸;(2)C为一元直链饱和脂肪酸,则C为:CH3(CH2)16COOH,所以答案是:CH3(CH2)16COOH;(3)a、根据分析可知,G属于酯类物质,分子中含有O元素,所以生物柴油G的主要成分属于酯类,不属于烃类物质,故a错误;b、生物柴油的主要成分为酯类物质,则石化柴油相比含硫量低,具有优良的环保特性,故b正确;c、生物柴油可通过反应获得,是一种可再生能源,则其资源不会像石油、煤炭那样会枯竭,故c正确;d、由于提炼生物柴油的原料可以用地沟油,所以生产生物柴油的成本低,但是现在我国还没有大面积使用生物柴油来代替矿物油,也没有彻底解决能源危机问题,故d错误;所以答案是:bc; (4)根据分析可知,a、E→G的反应为酯化反应,b、D→F为氧化反应,c、F→H为氧化反应,d、I→J为取代反应,e、J→K为消去反应,F、K→M为加聚反应,所以属于消去反应的只有e, 所以答案是:e;(5)F→H的转化中,第一步反应的化学方程式为:OHCCH2CHO+4Cu(OH)2+2NaOH
;J在浓硫酸作用下发生消去反应生成K,K发生加聚反应生成M;B为甘油,C为CH3(CH2)16COOH,二者发生酯化反应生成酯E,E再与据此发生酯化反应生成酯G,(1)D的结构简式为:CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,羧基在1号C,碳碳双键在9、12号C,该有机物名称为:9,12﹣十八碳二烯酸,所以答案是:9,12﹣十八碳二烯酸;(2)C为一元直链饱和脂肪酸,则C为:CH3(CH2)16COOH,所以答案是:CH3(CH2)16COOH;(3)a、根据分析可知,G属于酯类物质,分子中含有O元素,所以生物柴油G的主要成分属于酯类,不属于烃类物质,故a错误;b、生物柴油的主要成分为酯类物质,则石化柴油相比含硫量低,具有优良的环保特性,故b正确;c、生物柴油可通过反应获得,是一种可再生能源,则其资源不会像石油、煤炭那样会枯竭,故c正确;d、由于提炼生物柴油的原料可以用地沟油,所以生产生物柴油的成本低,但是现在我国还没有大面积使用生物柴油来代替矿物油,也没有彻底解决能源危机问题,故d错误;所以答案是:bc; (4)根据分析可知,a、E→G的反应为酯化反应,b、D→F为氧化反应,c、F→H为氧化反应,d、I→J为取代反应,e、J→K为消去反应,F、K→M为加聚反应,所以属于消去反应的只有e, 所以答案是:e;(5)F→H的转化中,第一步反应的化学方程式为:OHCCH2CHO+4Cu(OH)2+2NaOH ![]() NaOOCCH2COONa+2Cu2O↓+6H2O,所以答案是:OHCCH2CHO+4Cu(OH)2+2NaOH
NaOOCCH2COONa+2Cu2O↓+6H2O,所以答案是:OHCCH2CHO+4Cu(OH)2+2NaOH ![]() NaOOCCH2COONa+2Cu2O↓+6H2O;(6)I→J的转化中,第一步反应的化学方程式为:H3COOCCH2COOCH3+4
NaOOCCH2COONa+2Cu2O↓+6H2O;(6)I→J的转化中,第一步反应的化学方程式为:H3COOCCH2COOCH3+4 ![]() →
→  +2CH3OMgBr,所以答案是:H3COOCCH2COOCH3+4
+2CH3OMgBr,所以答案是:H3COOCCH2COOCH3+4 ![]() →
→  +2CH3OMgBr;7)J的结构简式为:
+2CH3OMgBr;7)J的结构简式为: 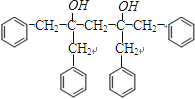 ,该分子中具有对称结构,其中4个
,该分子中具有对称结构,其中4个 ![]() 上的H等效,每个
上的H等效,每个 ![]() 上含有4种H原子,中间的﹣CH2﹣上含有1种H,不包括羟基中的H,该有机物分子中总共含有5种等效H原子,所以其一氯代物有5种,
上含有4种H原子,中间的﹣CH2﹣上含有1种H,不包括羟基中的H,该有机物分子中总共含有5种等效H原子,所以其一氯代物有5种,
所以答案是:5.

【题目】电石中的碳化钙和水能完全反应:CaC2+2H2O═C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量.
(1)若用下列仪器和导管组装实验装置:
序号 | 1 | 2 | 3 | 4 | 5 | 6 |
导管及仪器 |
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | ||||||
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:接接接接接 .
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞.
②检查装置的气密性.
③在仪器6和5中注入适量水.
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计).
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞.
正确的操作顺序(用操作编号填写)是 .
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有杂质.
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是 %.
【题目】直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 .
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是;
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性,用化学平衡原理解释;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):;
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: 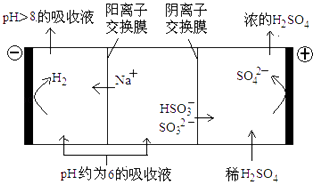
①HSO3﹣在阳极放电的电极反应式是;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理 .