题目内容
【题目】CO2是温室气体,研究CO2的应用对促进低碳生活具有重要意义。
(1)1922年德国工业化生产尿素
Ⅰ:2NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
Ⅱ:NH3COONH4(s) ![]() CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
①写出用NH3和CO2合成尿素总反应的热化学方程式_________;按照酸碱质子理论,能接受H+的物质为碱,现常温下溶液中存在反应:NH3+NH2COOH![]() NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
②在一个体积恒为1L的恒温密闭容器中充入2molCO2和4molNH3的混合气体,经历反应Ⅰ、Ⅱ合成CO(NH2)2,混合气体中的氨气体积分数及气体总浓度随时间变化如下图所示。
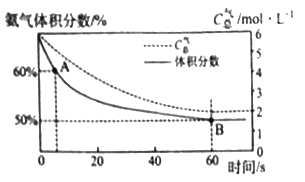
对于反应Ⅰ:A点的正反应速率与B点的逆反应速率的大小关系是:v![]() _______v
_______v![]() (填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
(填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能_______(“增大”“减小”或“不变”)
(2)利用二氧化碳制备乙烯
用惰性电极电解强酸性二氧化碳水溶液可得到乙烯,其原理如下图所示。
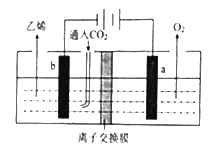
①b电极上的电极反应式为______________;
②该装置中使用的是___________(填“阴” 或“阳”)离子交换膜。
【答案】 2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g) ΔH=-87.00kJ·mol-1 强于 > 逐渐减小 75% 减小 2CO2+12e-+12H+=C2H4+H2O 阳
CO(NH2)2(s)+H2O(g) ΔH=-87.00kJ·mol-1 强于 > 逐渐减小 75% 减小 2CO2+12e-+12H+=C2H4+H2O 阳
【解析】(1)①已知:Ⅰ:2NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
Ⅱ:NH3COONH4(s) ![]() CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
则根据盖斯定律可知Ⅰ+Ⅱ即得到用NH3和CO2合成尿素应的热化学方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH=-87.00kJ·mol-1;根据NH3+NH2COOH
CO(NH2)2(s)+H2O(g) ΔH=-87.00kJ·mol-1;根据NH3+NH2COOH![]() NH2COONH4(K=1×1010)可知氨气能结合羧基电离出的氢离子,所以碱性:NH3强于NH2COONH4。②根据图像可知B点反应达到平衡状态,A点在B点之前,所以对于反应Ⅰ:A点的正反应速率大于B点的逆反应速率。第一步反应是放热反应,当温度升高时平衡向逆反应方向进行,所以平衡常数K1值的变化趋势为逐渐减小;则根据B点平衡时氨气为50%,气体总浓度是2mol/L,所以氨气的平衡浓度是2mol×50%=1mol/L,所以消耗氨气是3mol/L,因此B点氨气的转化率为3/4×100%=75%;对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能减小。
NH2COONH4(K=1×1010)可知氨气能结合羧基电离出的氢离子,所以碱性:NH3强于NH2COONH4。②根据图像可知B点反应达到平衡状态,A点在B点之前,所以对于反应Ⅰ:A点的正反应速率大于B点的逆反应速率。第一步反应是放热反应,当温度升高时平衡向逆反应方向进行,所以平衡常数K1值的变化趋势为逐渐减小;则根据B点平衡时氨气为50%,气体总浓度是2mol/L,所以氨气的平衡浓度是2mol×50%=1mol/L,所以消耗氨气是3mol/L,因此B点氨气的转化率为3/4×100%=75%;对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能减小。
(2)①b电极与电源的负极相连,作阴极,溶液中的CO2得到电子转化为乙烯,溶液显酸性,因此阴极上的电极反应式为2CO2+12e-+12H+=C2H4+H2O;②为了防止氢氧根离子与CO2反应,因此该装置中使用的是阳离子交换膜。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案