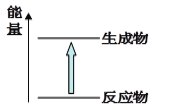
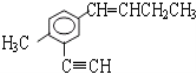
题目内容
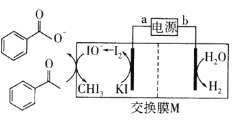
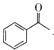
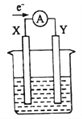
【题目】以Fe3O4/Pd为催化材料,利用电化学原理实现H2消除酸性废水中的![]() ,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
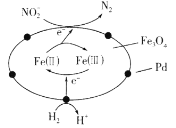
A.处理![]() 的电极反应为2NO2-+8H++6e-=N2↑+4H2O
的电极反应为2NO2-+8H++6e-=N2↑+4H2O
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.用该法处理后,水体的pH降低
D.消耗标准状况下6.72LH2,理论上可处理含NO2-4.6mg·L-1的废水2m3
【答案】C
【解析】
A.根据图示,处理![]() 得到电子转化为氮气,电极反应为2NO2-+8H++6e-=N2↑+4H2O,故A正确;
得到电子转化为氮气,电极反应为2NO2-+8H++6e-=N2↑+4H2O,故A正确;
B.Fe(Ⅲ)得电子生成Fe(Ⅱ),Fe(Ⅱ)失电子生成Fe(Ⅲ),则Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用,故B正确;
C.根据图示,总反应方程式可知:2H++2NO2+3H2![]() N2+4H2O,所以用该法处理后水体的pH升高,故C错误;
N2+4H2O,所以用该法处理后水体的pH升高,故C错误;
D.根据C项的总反应2H++2NO2+3H2![]() N2+4H2O,消耗标准状况下6.72LH2即为
N2+4H2O,消耗标准状况下6.72LH2即为![]() =0.3mol,理论上可处理NO2-的物质的量=
=0.3mol,理论上可处理NO2-的物质的量=![]() ×0.3mol=0.2mol,可处理含4.6mg·L-1 NO2-废水的体积=
×0.3mol=0.2mol,可处理含4.6mg·L-1 NO2-废水的体积=![]() =2×103L=2m3,故D正确;
=2×103L=2m3,故D正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
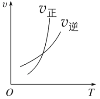
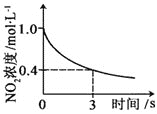
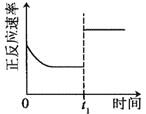
小学生10分钟应用题系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
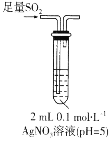
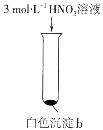
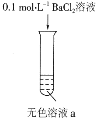
【题目】某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:
序号 | Ⅰ | Ⅱ | Ⅲ |
实验 步骤 |
|
|
|
实验现象 | 得到无色溶液a和白色沉淀b | 产生无色气体,遇空气变为红棕色 | 产生白色沉淀 |
下列说法正确的是
A.透过测Ⅰ中无色溶液a的pH可以判断SO2是否被氧化
B.实验Ⅱ说明白色沉淀b具有还原性
C.实验Ⅲ说明溶液a中一定有![]() 生成
生成
D.实验Ⅰ、Ⅱ、Ⅲ说明SO2与AgNO3溶液反应既有Ag2SO4生成,又有Ag2SO3生成