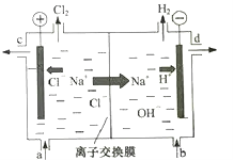
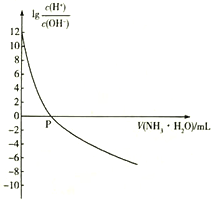
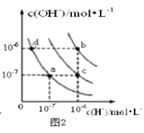
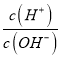题目内容
【题目】25℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
A.平衡逆向移动I-浓度减小B.溶度积常数Ksp减小
C.沉淀溶解平衡不移动D.PbI2的溶解度减小
【答案】D
【解析】
含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,c(Pb2+)减小,溶度积常数Ksp只与温度有关。
Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,c(Pb2+)减小,溶度积常数Ksp只与温度有关。
A. 含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡左移,故A错误;
Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡左移,故A错误;
B. 溶度积常数Ksp只与温度有关,改变c(I-)Ksp不变,故B错误;
C. 加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,故C错误;
D.加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,PbI2的溶解度减小,故D正确;
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目