题目内容
【题目】下列说法正确的是
A.氧化还原反应中可能只有一种元素的化合价发生变化
B.金属离子被还原一定得到金属单质
C.阳离子只有氧化性,阴离子只有还原性
D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
【答案】A
【解析】
A.氧化还原反应中可能是同种元素被氧化又被还原,如氯气与水的反应中只有Cl元素的化合价变化,故A正确;
B.金属离子被还原可能得到金属离子,如铁离子被还原为亚铁离子,故B错误;
C.阳离子可能既有氧化性又有还原性,如亚铁离子;阴离子可能既有氧化性又有还原性,如亚硫酸根离子等,故C错误;
D.在氧化还原反应中,氧化剂与还原剂可以为同种物质,如水的分解、氯气与水的反应等,故D错误;
故选A。

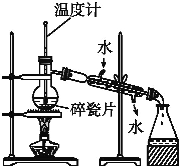
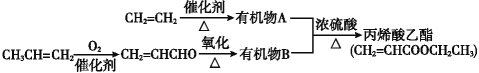
【题目】实验室按照图1所示装置制备氯酸钾、氯水并进行有关探究实验。
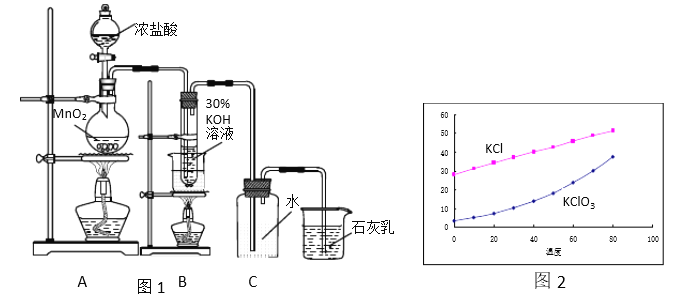
Ⅰ实验一 制取氯酸钾和氯水
(1)A中发生反应的化学方程式是_____________。
(2)制备KClO3需在70℃~80℃进行,写出制备KClO3的离子方程式______。
(3)装置C的作用是_____ 。
(4)KCl 和KClO3的溶解度如图2所示。反应结束后,将装置B中的溶液放到冰水浴中, 20秒后会析出较多晶体X。这样做是因为________(选填a、b、c):
a. KClO3溶解度受温度影响较大而KCl溶解度受温度影响较小
b. 0℃时,KClO3溶解度比KCl小
c. 溶液中的溶质主要是KClO3
所以在冷却过程中晶体X会沉淀析出,X的化学式是_______。
(5)上一步操作会不可避免地使另一种物质同时析出,因此要获得较纯净的X,需要进行的具体的操作步骤是_________________。
Ⅱ实验二 氯酸钾性质研究
(6)在不同条件下KClO3可将KI氧化为不同的产物。该小组设计了如下实验,研究反应条件对反应产物的影响(实验在室温下进行):
0.20 mol·L KI/ mL | KClO3(s) /g | 6.0 mol·L-1 H2SO4/ mL | 蒸馏水/ mL | |
试管1 | 1.0 | 0.10 | 0 | 9.0 |
试管2 | 1.0 | 0.10 | 3.0 | 6.0 |
①该实验的实验目的是__。
②设计试管1实验的作用是_____。
③实验后发现,试管2中产生黄色溶液,该同学预测KI被氧化为I2。用离子方程式表示该同学的预测____________;请设计2种实验方案验证该预测正确(从加入试剂、现象、结论等方面描述)______________。
【题目】下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )
选 项 | A | B | C | D |
物 质 | Na2O2 | H2O | HCl | NaCl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
A.A
B.B
C.C
D.D