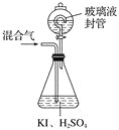
题目内容
【题目】氮化镁![]() 是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
已知:①氮化镁极易与水反应;②实验室在加热条件下用饱和![]() 溶液和饱和
溶液和饱和![]() 溶液混合制备
溶液混合制备![]() ;③焦性没食子酸溶液用于吸收少量
;③焦性没食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制备氮化镁。
他们选择下列装置设计实验(装置可重复使用):
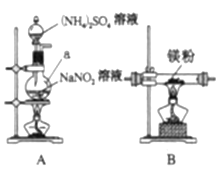
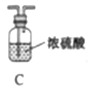

(1)仪器a的名称是____,氮化镁的电子式是____。
(2)气体从左至右,装置连接顺序为____。(填代号)
(3)写出A中发生反应的化学方程式:____。
(4)用化学方法检验产品中含有氮化镁![]() ,设计实验方案:____。
,设计实验方案:____。
Ⅱ.测定产品纯度。
利用如图装置测定氮化镁产品纯度(杂质不产生气体,氨气不溶于煤油)。
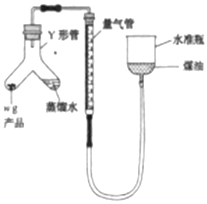
(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是__。
(6)取产品质量为wg,开始量气管读数为![]() ,最终量气管读数为
,最终量气管读数为![]() (折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
(折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
【答案】圆底烧瓶 ![]() A、D、C、B、C 2NaNO2+(NH4)2SO4
A、D、C、B、C 2NaNO2+(NH4)2SO4![]() Na2SO4+2N2↑+4H2O 取少量产品溶于足量的蒸馏水中,生成白色沉淀,加热后产生使湿润的红色石蕊试纸变蓝的气体,则证明产品中含有
Na2SO4+2N2↑+4H2O 取少量产品溶于足量的蒸馏水中,生成白色沉淀,加热后产生使湿润的红色石蕊试纸变蓝的气体,则证明产品中含有![]() 上下移动水准瓶
上下移动水准瓶 ![]() 偏高
偏高
【解析】
(1)根据仪器a特点,仪器a为圆底烧瓶;氮化镁为离子化合物,其电子式为![]() ;
;
答案为:圆底烧瓶;![]() ;
;
(2)实验目的是制备氮化镁,实验原理3Mg+N2![]() Mg3N2,装置A为制备N2,N2中混有氧气和水蒸气,下一步是除去氧气和水蒸气,然后得到N2,空气中有水蒸气,还要防止空气中水蒸气进入装置B中,B装置后还需要连接C,即顺序是A→D→C→B→C;
Mg3N2,装置A为制备N2,N2中混有氧气和水蒸气,下一步是除去氧气和水蒸气,然后得到N2,空气中有水蒸气,还要防止空气中水蒸气进入装置B中,B装置后还需要连接C,即顺序是A→D→C→B→C;
(3)A的作用是制备N2,其化学反应方程式为2NaNO2+(NH4)2SO4![]() Na2SO4+2N2↑+4H2O;
Na2SO4+2N2↑+4H2O;
答案为2NaNO2+(NH4)2SO4![]() Na2SO4+2N2↑+4H2O;
Na2SO4+2N2↑+4H2O;
(4)根据信息,氮化镁易与水反应,其反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,设计的方案为取少量产品溶于足量的蒸馏水中,生成白色沉淀,加热后产生使湿润的红色石蕊试纸变蓝的气体,则证明产品中含有Mg3N2;
答案为取少量产品溶于足量的蒸馏水中,生成白色沉淀,加热后产生使湿润的红色石蕊试纸变蓝的气体,则证明产品中含有Mg3N2;
(5)观察装置图可知,上下移动水准瓶可以调平水准瓶中液面和量气管内液面,确保量气管内的气压等于外界大气压;
答案为上下移动水准瓶;
(6)氮化镁与水反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,氨气的体积为(V2-V1)mL,根据反应方程式,氮化镁的纯度为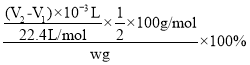 =
=![]() ;开始俯视刻度线,读数V1偏小,终点仰视刻度线,读数V2偏大,(V2-V1)偏大,即所测氮化镁的纯度偏高;
;开始俯视刻度线,读数V1偏小,终点仰视刻度线,读数V2偏大,(V2-V1)偏大,即所测氮化镁的纯度偏高;
答案为![]() ;偏高。
;偏高。

【题目】一定温度下,在三个容积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]()
![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反应温度 | 600 | 600 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的转化率 |
|
|
|
平衡常数K |
|
|
|
下列叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()