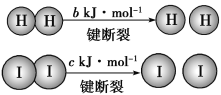
题目内容
【题目】2018 年 11 月《Nature Energy》报道了中科院大连化学物理研究所科学家用 Ni-BaH2/Al2O3、Ni-LiH 等作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)在元素周期表中,Li、O、H 三种元素的电负性由大到小的顺序为___________;Al 原子核外电子空间运动状态有 8 种,则该原子处于____(填“基态”或“激发态”)。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为 182℃,沸点为 233℃。
①硝酸溶液中 NO3的空间构型为__________ 。
②甘氨酸中 N 原子的杂化类型为 ________,分子中σ键与π键的个数比为_________;其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为 141℃)的主要原因:一是甘氨酸能形成内盐,二是______________。
(3)[Cu(NH3)4]2+在实验室中制备方法如下:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出蓝色沉淀溶解得到深蓝色溶液的离子方程式___________________。
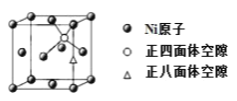
(4)X-射线衍射分析表明,由 Ni 元素形成的化合物 Mg2NiH4 的立方晶胞如图所示,其面心和顶点均被 Ni 原子占据,所有 Mg 原子的 Ni 配位数都相等。则 Mg 原子填入由 Ni 原子形成的 ___空隙中(填“正四面体”或“正八面体”),填隙率是____。
(5)已知 Mg2NiH4 晶体的晶胞参数为 646.5 pm,液氢的密度为0.0708 gcm-3。若以材料中氢的密度与液氢密度之比定义为储氢材料的储氢能力,在 Mg2NiH4 的储氢能力为____________(列出计算式即可)。
【答案】O>H>Li 激发态 平面三角形 sp3 9:1 甘氨酸分子间形成的氢键数比丙酸分子间形成的氢键数多(或甘氨酸中的氨基使分子间产生氢键) Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 正四面体 100% 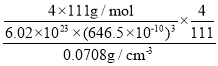
【解析】
(1)同一周期元素原子的电负性随着原子序数的递增而增大,同一主族元素原子的电负性随着原子序数的递增而减小,在Li、H、O三种元素中Li的电负性最小,O的电负性最大,则电负性从大到小的顺序为O>H>Li;基态Al原子核外电子空间运动状态有7种,当运动状态不为7种时为激发态;
(2)①NO3-的中心原子价层电子对数为![]() =3,孤电子对数为0,所以空间构型为平面三角形;
=3,孤电子对数为0,所以空间构型为平面三角形;
②甘氨酸中N原子形成两个N-H键和一个N-C键,达到饱和状态,价层电子对数为4,所以为sp3杂化;分子中碳氧双键中存在1个π键,其余均为σ键,所以分子中σ键与π键的个数比为9:1;分子质量相同时,甘氨酸分子间形成的氢键数比丙酸分子间形成的氢键数多(或甘氨酸中的氨基使分子间产生氢键);
(3)蓝色沉淀溶解得到深蓝色溶液的过程是氢氧化铜变成氢氧化四氨合铜的过程,离子方程式为Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)由晶体结构可知,Ni原子个数为4,所有Mg原子的Ni配位数相等,Mg原子数为8,则Mg原子填入由Ni原子形成的四面体空隙中,空隙占有率为100%;
(5)储氢能力=![]() =
=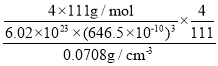 。
。

【题目】一定温度下,将1 mol X和3 mol Y置于2 L的恒容密闭容器中,发生反应:X(g)+3Y(g)2Z(g),反应过程中部分数据如表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
p/kPa | 32 | 28.8 | 27.2 | 26.88 | 26.88 |
下列说法正确的是
A.10min时,用Y表示的平均反应速率为0.03 mol·L-1·min-1
B.X和Y的转化率之比保持不变时,可判断反应达到平衡状态
C.平衡状态时,c(Z)=0.32 mol·L-1
D.用气体分压代替物质的量浓度计算该反应的平衡常数,数值不变