题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
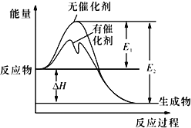
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能小于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
【答案】D
【解析】
A.由图可知,反应物总能量大于生成物总能量,为放热反应,则该反应的逆反应为吸热反应,且升高温度,提供了能量,提高了活化分子的百分数,故A正确;
B.催化剂不改变反应的反应热,能够降低反应的活化能,由图可知△H=E1-E2,故B正确;
C.该反应为放热反应,焓变等于断裂化学键吸收的能量减去形成化学键释放的能量,则该反应中反应物的总键能小于生成物的总键能,故C正确;
D.该反应为可逆反应,但热化学方程式中为完全转化时的能量变化,则1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)2SO3(g)△H<-2a kJmol-l,故D错误;
故选D。

练习册系列答案
相关题目