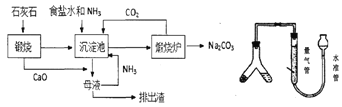
题目内容
【题目】Ⅰ.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)
如图所示是配制50 mL KMnO4标准溶液的过程示意图。
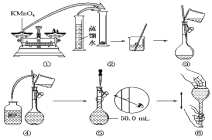
(1)请你观察图示判断,其中不正确的操作有__________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)配平草酸与KMnO4反应的离子方程式:__MnO+ H2C2O4+ H+=== Mn2++ CO2↑+ H2O。
(5)滴定终点时的现象是_____________________________________
(6)经过计算,血液样品中Ca2+的浓度为__________m mol·cm-3。
Ⅱ. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
实验1试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)。
操作 | 现象 |
取2 mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是_________。
(2)产生气泡的原因是____________________________________________。
【答案】 ②⑤ 50 mL容量瓶 偏小 2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 当滴入最后一滴KMnO4溶液时,溶液颜色有无色变为粉红色,但半分钟内不褪色 0.03 ![]() 2Fe2++2H++H2O2=+2Fe3++2H2O Fe3+催化下H2O2分解生成O2
2Fe2++2H++H2O2=+2Fe3++2H2O Fe3+催化下H2O2分解生成O2
【解析】本题考查化学实验方案的设计与评价。
解析:Ⅰ.(1)量筒不能用于配制溶液,视线应该与凹液面的最低点相平读数,所以②⑤操作错误;(2)配制50mL一定物质的量浓度KMnO4标准溶液需要50mL的容量瓶;(3)仰视读数时,定容时,所加的水超过刻度线,体积偏大,所以浓度偏小;(4)由题给未配平的离子方程式可知,反应中H2C2O4做还原剂被氧化为CO2,MnO4―做氧化剂被还原为Mn2+,依据得失电子数目守恒和原子个数守恒可得配平的化学方程式为2MnO4―+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;(5)草酸溶液无色,当反应正好完全进行的时候,多加一滴KMnO4溶液,溶液恰好由无色变为紫红色;(6)血样处理过程中存在如下关系式:5Ca2+~5CaC2O4~5H2C2O4~2MnO4―,所以n(Ca2+)=![]() n(MnO4-)=
n(MnO4-)=![]() ×0.0120L×0.020mol·L-1=6.0×10-4mol,血液样品中Ca2+的浓度=
×0.0120L×0.020mol·L-1=6.0×10-4mol,血液样品中Ca2+的浓度=![]() =0.03mmol·cm-3。Ⅱ. H2O2为含有非极性键和极性键的共价化合物,电子式为
=0.03mmol·cm-3。Ⅱ. H2O2为含有非极性键和极性键的共价化合物,电子式为![]() ,酸性条件下,H2O2溶液与FeSO4溶液发生反应生成Fe3+和H2O,反应的离子方程式为:2Fe2++2H++H2O2=+2Fe3++2H2O;(2)氧化氢在Fe3+离子催化作用下分解生成氧气,故产生气泡。
,酸性条件下,H2O2溶液与FeSO4溶液发生反应生成Fe3+和H2O,反应的离子方程式为:2Fe2++2H++H2O2=+2Fe3++2H2O;(2)氧化氢在Fe3+离子催化作用下分解生成氧气,故产生气泡。