题目内容
【题目】下列说法中错误的是 ( )
A.在豆浆中加少量石膏,能使豆浆凝结成豆腐
B.误服可溶性重金属盐,立刻服用大量的牛奶或蛋青解毒
C.用灼烧的方法可鉴别毛织物和棉织物
D.温度越高,酶对某些化学反应的催化效率越高
【答案】D
【解析】
A选项,在豆浆中加少量石膏,能使豆浆凝结成豆腐,是蛋白质盐析的过程,故A正确;
B选项,误服可溶性重金属盐,立刻服用大量的牛奶或蛋青解毒,让牛奶蛋白质和重金属盐发生变性作用,从而降低重金属盐对人体蛋白质的损害,故B正确;
C选项,灼烧毛织物有烧焦羽毛的气味,可用灼烧的方法可鉴别毛织物和棉织物,故C正确;
D选项,酶是特殊蛋白质,温度越高,会使蛋白质变性,失去生理活性,故D错误;
综上所述,答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)
如图所示是配制50 mL KMnO4标准溶液的过程示意图。
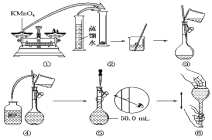
(1)请你观察图示判断,其中不正确的操作有__________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)配平草酸与KMnO4反应的离子方程式:__MnO+ H2C2O4+ H+=== Mn2++ CO2↑+ H2O。
(5)滴定终点时的现象是_____________________________________
(6)经过计算,血液样品中Ca2+的浓度为__________m mol·cm-3。
Ⅱ. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
实验1试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)。
操作 | 现象 |
取2 mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是_________。
(2)产生气泡的原因是____________________________________________。