题目内容
【题目】常温下,下列溶液中各微粒浓度关系不正确的是( )
A.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>②
B.向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)>c(SO42-)>c(OH-)=c(H+)
C.向1L 0.1mol/L的NaOH溶液中通入6.6gCO2:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
【答案】C
【解析】
A.阴离子水解程度大小关系是CH3COO-<HCO3-<C6H5O-,等pH的这三种盐溶液,盐浓度大小顺序是:①>③>②,所以c(Na+)大小关系:①>③>②,正确;
B.溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)=2c(SO42-),正确;
C.氢氧化钠的物质的量是0.1mol,n(CO2)=![]() mol=0.15mol,氢氧化钠和二氧化碳的物质的量之比是0.1mol:0.15mol=2:3,所以二氧化碳和氢氧化钠发生的反应为CO2+NaOH=NaHCO3,二氧化碳有剩余,溶液中的溶质是碳酸氢钠,根据物料守恒得c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),错误;
mol=0.15mol,氢氧化钠和二氧化碳的物质的量之比是0.1mol:0.15mol=2:3,所以二氧化碳和氢氧化钠发生的反应为CO2+NaOH=NaHCO3,二氧化碳有剩余,溶液中的溶质是碳酸氢钠,根据物料守恒得c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),错误;
D.溶液中存在电荷守恒c(Na+)+c(H+)+c(K+)=c(CH3COO-)+c(OH-) +c(NO3-),硝酸钾是强酸强碱盐,则c(K+)=c(NO3-),所以得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),正确。
故选C。

【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
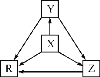
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为______________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
(2)已知:2NO2(g)![]() N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g)![]() N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是(选填字母)_____________。
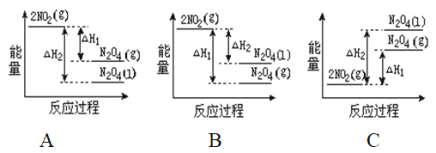
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):___________________________。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。 已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_________。
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________;
(2)写出元素②的最简单氢化物的化学式____________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______________________________________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_______________。