题目内容
【题目】高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图甲是高铁电池的实验装置:已知放电后,两极得到铁的相同价态的化合物。
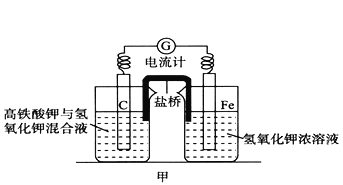
(1)该电池放电时正极发生的电极反应是___________。
(2)若该电池属于二次电池,则充电时阴极反应的电极反应式为___________ 。
(3)已知盐桥中含有饱和KCl溶液,放电时,盐桥的作用是___________。此盐桥中阴离子的运行方向是___________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是___________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为___________mol·L1,此时溶液中c(CrO42-)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】 FeO42-+4H2O+3e- =Fe(OH)3↓+5OH- Fe(OH)3+3e- =Fe+3OH- 形成闭合回路 左池到右池 K+和H+ 2.0×10-5 5.0×10-3
【解析】(1)FeO42-在正极得电子生成Fe3+,该电池放电时正极发生的电极反应为:FeO42-+4H2O+3e- =Fe(OH)3↓+5OH-;(2)充电时Fe(OH)3在阴极得电子生成Fe,其电极反应式为:Fe(OH)3+3e- =Fe+3OH-;(3)盐桥中含有饱和KCl溶液,盐桥能够使装置形成闭合回路,并保持两边溶液呈电中性。此盐桥中阴离子的运行方向是向负极移动,即从左池到右池;该隔膜应该是阳离子交换膜,允许通过的离子是K+和H+。(4)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=2.0×10-10/1.0×10-5= 2.0×10-5mol/L,此时溶液中c(CrO42-)= 2.0×10-12/(2.0×10-5)2= =5.0×10-3mol/L。

 特高级教师点拨系列答案
特高级教师点拨系列答案