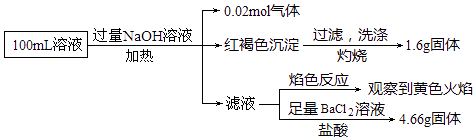
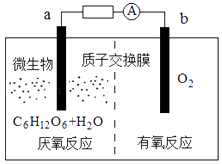
��Ŀ����
����Ŀ��ij��ɫ��Һ��ֻ���ܺ���K����Ag����Ba2����Cu2����Cl����OH����CO ![]() ��SO
��SO ![]() �е�һ�ֻ��֣������������ʵ��������� ��
�е�һ�ֻ��֣������������ʵ��������� ��
��ȡ������Һ���μ���ɫ��̪��Һ����̪��죻
����ȡ������Һ����������BaCl2��Һ��������ɫ������
����(2)���û�����м��������ᣬ���������ܽ⣬������ɫ�������ɣ�
�Ƚ�(3)���û������ˣ�����Һ�м���AgNO3��Һ���а�ɫ�������ɡ�
���жԸ���Һ��˵����ȷ����
A.һ������OH����CO ![]() ��SO
��SO ![]() ��Cl��
��Cl��
B.���ܺ���K����Cl��
C.һ��������Ag����Ba2����Cu2��
D.���ж�
���𰸡�C
��������(1)ȡ������ɫ��Һ���μ���ɫ��̪��Һ����̪��죬֤����Һ��ʾ���ԣ�һ�������ڣ�Ag+��Cu2+�����ܴ���OH-���ܹ�ˮ������������CO32-��(2)��ȡ������Һ����������BaCl2��Һ��������ɫ�����������CO32-��SO42-�е�����һ�֣�(3)��(2)���û�����м��������ᣬ���������ܽ⣬������ɫ�������ɣ�֤������̼�ᱵ�����ᱵ���ֳ�����̼�ᱵ�������ᣬ���ᱵ���ܣ�һ������CO32-��SO42-�������ӣ���һ�������ڱ����ӣ�(4)��(3)���û������ˣ�����Һ�м���Ag NO3��Һ���а�ɫ�����Ȼ������ɣ��ϲ�����������������ӣ�����ȷ���������Ƿ���ڡ���Һ�в���ֻ���������ӣ�һ�����������ӣ���һ�����ڼ����ӡ����Ͽ�֪��һ������K+��CO32-��SO42-��һ��������Ba2+��Cu2+��Ag+�����ܺ���Cl-��OH-��
���Դ��ǣ�C

 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�