题目内容
【题目】【镇江市2017届三模(最后一卷)】α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为: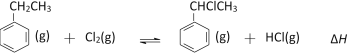
在T℃时,向2.0 L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是
A.反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol·L-1·min-1
B.10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH>0
C.在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 mol α-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行
D.在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20%
【答案】BC
【解析】A、0~2min内生成HCl的物质的量为0.20mol,同时生成α-氯乙基苯物质的量为0.20mol,根据化学反应速率数学表达式,v(α-氯乙基苯)=0.2/(2×2)mol/(L·min)=0.05 mol/(L·min),故A错误;B、10min是c(α-氯乙基苯)=0.32/2mol·L-1=0.16mol·L-1,升高温度,重新达到平衡,c(α-氯乙基苯)=0.18mol·L-1<0.16mol·L-1,说明升高温度,平衡向正反应方向进行,即正反应是吸热反应,△H>0,故B正确;C、T℃时,充入0.4mol乙苯和0.4mol氯气,反应达到平衡时c(乙苯)=c(Cl2)=(0.4-0.32)/2mol·L-1=0.04mol·L-1,c(α-氯乙基苯)=c(HCl)=0.32/2mol·L-1=0.16mol·L-1,K=(0.16×0.16)/(0.04×0.04) =16,起始时充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 mol α-氯乙基苯(g)、0.50 mol HCl(g),此时的Qc=(0.25×0.25)/(0.5×0.25)=0.5<16,说明反应向正反应方向进行,故C正确;D、当通入2.0molα-氯乙基苯和2molHCl时,与原来平衡构成等效平衡,α-氯乙基苯的转化率应等于20%,然后再通入0.2molHCl,平衡向逆反应方向进行,α-氯乙基苯转化率增大,即大于20%,故D错误。