题目内容
【题目】【湖南省2017届考前模拟卷(3)】室温时,将0.10 mol·L1 NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示。当V(NaOH)=20.00 mL,二者恰好完全反应。则下列有关说法不正确的是

A.该一元酸溶液浓度为0.10 mol·L1
B.a、b、c点的水溶液导电性依次增强
C.室温时,HA的电离常数Ka≈l×105
D.a点和c点所示溶液中H2O的电离程度相同
【答案】C
【解析】A、根据信息,当V(NaOH)=20mL时,二者恰好完全反应,NaOH+HA=NaA+H2O,因此c(HA)=0.1mol·L-1,故说法正确;B、导电性与溶液中离子浓度以及所带电荷数有关,离子浓度越大,所带电荷数越多,导电能力越大,根据起点HA的pH=2,说明HA为弱酸,a点溶质为NaA和HA,HA物质的量较多,b点时溶质NaA和HA,NaA较多,c点时溶质为NaA和NaOH,都是强电解质,因此导电能力c>b>a,故说法正确;C、HA ![]() H++A-,电离产生的c(H+)=c(A-)=10-2mol·L-1,弱电解质电离程度微弱,即c(HA)约为0.1mol·L-1,根据电离平衡常数的表达式K=c(H+)×c(A-)/c(HA)=10-2×10-2/0.1=10-3,故说法错误;D、a点对应的pH=3,即溶液中c(H+)=10-3mol·L-1,c点时pH=11,溶液中c(OH-)=10-3mol·L-1,两点对水的电离抑制能力相同,故说法正确。
H++A-,电离产生的c(H+)=c(A-)=10-2mol·L-1,弱电解质电离程度微弱,即c(HA)约为0.1mol·L-1,根据电离平衡常数的表达式K=c(H+)×c(A-)/c(HA)=10-2×10-2/0.1=10-3,故说法错误;D、a点对应的pH=3,即溶液中c(H+)=10-3mol·L-1,c点时pH=11,溶液中c(OH-)=10-3mol·L-1,两点对水的电离抑制能力相同,故说法正确。

【题目】【湖南省2017年考前演练卷(三)】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 k J·mol1
2NO(g) ΔH=+180.5 k J·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 k J·mol1
2NO2(g) ΔH=116.5 k J·mol1
回答下列问题:
(1)CO的燃烧热为_________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为___________kJ。
(2)CO将NO2还原为单质的热化学方程式为_______。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.28 | 2.75 | 2.70 | 2.70 |
①前2 s内的平均反应速率v(N2)=___________,此温度下,该反应的平衡常数K=________。
②能说明上述反应达到平衡状态的是_________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因是___________ ,图中压强(p1,p2

【题目】【镇江市2017届三模(最后一卷)】α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为: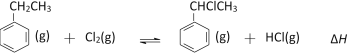
在T℃时,向2.0 L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是
A.反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol·L-1·min-1
B.10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH>0
C.在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 mol α-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行
D.在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20%