题目内容
下列说法不正确的是( )
| A.等质量的乙烯和丙烯中含有的共用电子对数目相等 |
| B.等质量14NO和13C0气体中含有的中子数相等 |
| C.10. 6 g Na2CO3固体中含阴阳离子总数约为1.806 x 1023 |
| D.5.6 g铁和6. 4 g铜分别与0.1mol氯气完全反应,转移的电子数相等 |
B
解析试题分析:A乙烯与丙烯的最简式都为CH2,平均每个碳原子形成3对共用电子,质量相同所含的碳原子数相同,故A正确;等质量14NO和13C0气体物质的量并不相等,故所含中子数亦不同,故B错误;10. 6 g Na2CO3的物质的量为0.1mol,阴阳离子总物质的量为0.3mol,总数为1.806 x 1023,故C正确;5.6 g铁和6. 4 g铜分别与0.1mol氯气均恰好完全反应,转移的电子数即为0.1mol氯气转移的电子数,故相等。所以选B
考点:考查基本概念

某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-(其中碳元素为+2价)、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是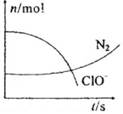
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO-,还原产物是HCO3- |
| C.配平后氧化剂与还原剂的化学计量数之比为5:2 |
| D.若生成2.24LN2(标准状况),则转移电子0.5mol |
同位素示踪法可用于反应机理的研究,下列反应中,同位素示踪表示正确的是
| A.CH3COOH+C2H18 5OH→CH3COOC2H5+H18 2O |
B.NH4Cl+2H2O NH3·2H2O+HCl NH3·2H2O+HCl |
| C.K37ClO3+6HCl=K37Cl+3Cl2↑+3 H2O |
| D.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O |
在NaIO3的碱性溶液中通入氯气,可以得到Na2H3IO6。下列有关该反应的说法错误的是
| A.在该反应中NaIO3作还原剂 |
| B.碱性条件下,氯气氧化性强于Na2H3IO6 |
| C.反应中生成1mol Na2H3IO6,转移2mol电子 |
| D.反应中氧化产物与还原产物的物质的量比为2:1 |
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.Co2O3 + 6 HCl=2CoCl2 + Cl2↑+ 3H2O |
| B.Cl2 + FeI2 = FeCl2 + I2 |
| C.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 |
| D.2Fe3+ + 2I— = 2Fe2++ I2 |
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列不正确的是( )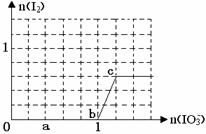
| A.0~b :3HSO3-+ IO3-= 3SO42-+ I-+ 3H+ |
| B.a点时消耗NaHSO3的物质的量为1.2 mol |
| C.b~c间I2是还原产物 |
| D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的KIO3为1.8mol |
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: SiO2 + C + N2 Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是 。
(3)分析反应可推测碳、氮气的氧化性:C N2(填“>”“<”“=”)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是 。
| A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
| B.在电子工业上制成耐高温的电的良导体 |
| C.研发氮化硅的全陶发动机替代同类型金属发动机 |
| D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物质量为n(3x+1)mol | B.处理废水中Cr2O72-的物质量为 mol mol |
| C.反应中发生转移的电子数为1.5nxmol | D.在FeO·FeyCrxO3中3x=y |