题目内容
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.Co2O3 + 6 HCl=2CoCl2 + Cl2↑+ 3H2O |
| B.Cl2 + FeI2 = FeCl2 + I2 |
| C.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 |
| D.2Fe3+ + 2I— = 2Fe2++ I2 |
C
解析试题分析:A、Co2O3的氧化性强于氯气的,即Co2O3能氧化氯离子生成氯气,所以反应Co2O3 + 6 HCl=2CoCl2 + Cl2↑+ 3H2O可以发生,A不符合题意;B、碘离子的还原性强于亚铁离子的,所以氯气和碘化亚铁反应时,首先氧化碘离子,B中反应可以发生,不符合题意;C、碘离子的还原性强于亚铁离子的,所以氯气和碘化亚铁反应时,首先氧化碘离子,因此C中反应不能发生,符合题意;D、铁离子的氧化性强于碘离子,能把碘离子氧化生成单质碘,D不符合题意,答案选C。
考点:考查氧化还原反应的有关判断和应用

一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(铜元素、硫元素的存在形式分别为Cu2+、SO42-)加入足量NaOH稀溶液,产生蓝色沉淀,过滤,洗涤,灼烧沉淀,得到CuO固体12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则VL可能为
| A.7.5L | B.9.5L | C.13.6L | D.16.8L |
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O
下列说法中,不正确的是 ( )
| A.S2O32-是还原剂 | B.Y的化学式为Fe2O3 |
| C.a=4 | D.每有1molO2参加反应,转移的电子总数为4mol |
下列说法不正确的是( )
| A.等质量的乙烯和丙烯中含有的共用电子对数目相等 |
| B.等质量14NO和13C0气体中含有的中子数相等 |
| C.10. 6 g Na2CO3固体中含阴阳离子总数约为1.806 x 1023 |
| D.5.6 g铁和6. 4 g铜分别与0.1mol氯气完全反应,转移的电子数相等 |
下列说法正确的是( )
| A.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
| B.Na2CO3溶液中c(Na+)与c(CO32ˉ )之比为2:1 |
| C.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 |
| D.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH=2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.制备高铁酸钾用ClO?做还原剂 |
| B.制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 |
| D.用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体 |
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是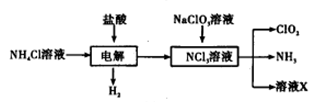
A.电解时发生反应的化学方程式为: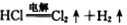 |
| B.由NaClO3溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的成分为NaClO3和NaOH |
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O